
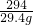 =
=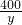
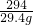 =
=
 ×100%=80%
×100%=80%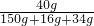 ×100%=20%
×100%=20%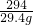 =
=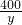 ;
;

 同步奥数系列答案
同步奥数系列答案科目:初中化学 来源: 题型:
| 294 |
| 29.4g |
| 400 |
| y |
| 294 |
| 29.4g |
| 400 |
| y |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
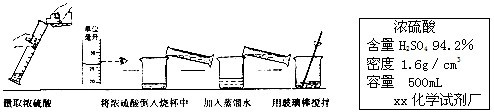
张南同学想测定赤铁矿中氧化铁的质量分数,做法如下,请回答下列问题。
(1)配制稀硫酸。
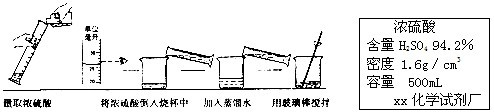
①配制200g 19.6%的稀硫酸,需要98%的浓硫酸的体积是 ;


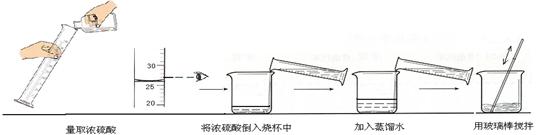
②下图实验过程中出现操作的错误是 。


(2)将赤铁矿粉末,用稀硫酸溶解,反应的化学方程式是 ;
(3)取20g的赤铁矿粉末恰好与l50g的19.6%的稀硫酸完全反应,求解生成硫酸铁质量(x)的比例式为 ;
(4)此赤铁矿中氧化铁的质量分数为 ;
(5)向反应后所得溶液中加入34g水,则所得溶液溶质的质量分数是
查看答案和解析>>
科目:初中化学 来源:2011年黑龙江省哈尔滨市南岗区中考化学调研模拟试题(一) 题型:计算题
(6分)张南同学想测定赤铁矿中氧化铁的质量分数,做法如下,请回答下列问题。
(1)配制稀硫酸。
①配制200g 19.6%的稀硫酸,需要98%的浓硫酸的体积是 ;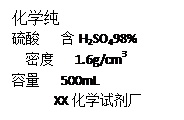
②下图实验过程中出现操作的错误是 。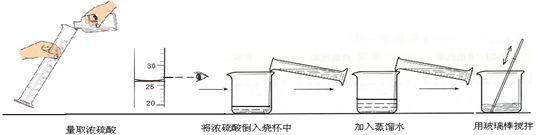
(2)将赤铁矿粉末,用稀硫酸溶解,反应的化学方程式是 ;
(3)取20g的赤铁矿粉末恰好与l50g的19.6%的稀硫酸完全反应,求解生成硫酸铁质量(x)的比例式为 ;
(4)此赤铁矿中氧化铁的质量分数为 ;
(5)向反应后所得溶液中加入34g水,则所得溶液溶质的质量分数是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com