
农技员对某土地检测后给出了施肥配方,配方中主要有K2SO4、NH4NO3、NH4H2PO4等物质。请回答下列问题:
(1)上述物质中属于钾肥的是________。
(2)取少量配方中的物质溶解于水,所得溶液的pH=6.2,则该溶液显________性。
(3)NH4NO3和NH4H2PO4不能与____________混合施用,以防止肥效降低。
K2SO4 酸 碱性物质 【解析】(1)NH4NO3、NH4H2PO4中都含有两种营养元素,属于复合肥;K2SO4中含有钾元素,属于钾肥;(2)溶液的pH=6.2,小于7,显酸性;(3)NH4NO3、NH4H2PO4不能与碱性物质混合施用的原因是NH4NO3、NH4H2PO4属于铵盐,与碱性肥料混合使用时能反应生成氨气,从而降低肥效。科目:初中化学 来源:江苏省常州市溧阳市2017~2018学年度第二学期九年级学业水平调研测试 题型:单选题
某化学反应的微粒变化如图所示,下列有关说法中错误的是
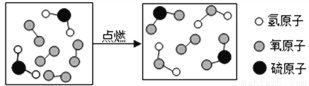
A. 反应前后原子的种类不变
B. 生成物有三种
C. .不属于置换反应
D. 反应物中没有氧化物
B 【解析】A、由微粒的变化可知,化学反应前后原子的种类不变,正确;B、由微粒的构成可知,反应物氧气过量,生成物只有两种为二氧化硫和水,错误;C、由化学反应的微观示意图可知,该反应由两种物质生成了两种物质,生成物中没有单质,不属于置换反应,错误;D、由微粒的变化可知,反应物为硫化氢和氧气,反应物中没有氧化物,正确。故选B。查看答案和解析>>
科目:初中化学 来源:山东省临沂市费县2018届九年级学业水平考试模拟训练一化学试卷 题型:填空题
铁是生产生活中应用最广泛的一种金属。
⑴在酱油中加入铁强化剂,是我国为解决________(填“甲状腺肿大”、“贫血”或“骨质疏松”)而实施的项目。
⑵铁元素与地壳中含量最多的元素组成化合物的化学式为________(写出一种即可)。
⑶常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。请将下列脱氧中的主要反应的化学方程式补充完整:4Fe(OH)2+O2+2________=4Fe(OH)3。
贫血 Fe3O4(或Fe2O3或FeO) H2O 【解析】(1)铁是血红蛋白的成分,在酱油中加入铁强化剂,是我国为解决贫血而实施的项目;(2)地壳中含量最多的元素是氧元素,与铁元素组成化合物有:FeO、Fe2O3、Fe3O4等;(3)化学反应前后各元素的原子个数不变,反应后含有4个Fe原子,12个O原子,12个H原子,反应前含有4个Fe原子,10个O原子,8个H原子,故该物质的一个分子中含有...查看答案和解析>>
科目:初中化学 来源:山东省临沂市费县2018届九年级学业水平考试模拟训练一化学试卷 题型:单选题
物质的性质决定其用途。下列用途是利用物质物理性质的是
A. 铜用于制作导线 B. 生石灰用作食品干燥剂
C. 稀盐酸用于除铁锈 D. 碳酸氢钠用于治疗胃酸过多
A 【解析】试题分析:铜用于制作导线是利用铜的导电性,导电性属于物质的物理性质。故选A.查看答案和解析>>
科目:初中化学 来源:陕西省西安市碑林区2014-2015学年九年级第二次模拟考试化学 题型:实验题
实验室常用图中(a)~(e)装置制取和收集气体。
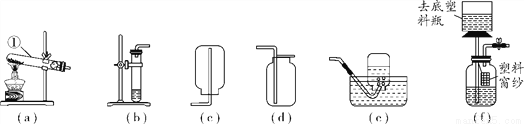
(1)写出标有①的仪器名称:________。
(2)小华同学用石灰石和稀盐酸反应制取二氧化碳气体,应选择的发生装置与收集装置的组合是________[选填字母(a)~(e)]。
(3)小玉同学认为(b)装置可用于过氧化氢溶液和二氧化锰混合制取氧气,其中二氧化锰的作用是__________________。
(4)小明是一位爱动手做实验的同学,他找来塑料瓶和一些其他用品,制作成如图(f)的装置。图中去底塑料瓶和其相连导管的组合相当于实验室中的____________(填一种仪器的名称),该装置作为制取二氧化碳气体发生装置的优点是______________________。
试管 (b)(d) 催化作用 长颈漏斗 随开随用,随关随停 【解析】(1)据图可知①的仪器名称:试管;(2)实验室制取二氧化碳是固液制气不需加热,故选b,因其密度比空气大能溶于水故采用向上排空气法收集;(3)利用b装置制取氧气用双氧水作反应物,二氧化锰作催化剂起催化作用;(4)f装置的特点就是能随时把塑料窗纱提起使反应随时停止,放下时反应就会发生,类似于启普发生器的制气优点。查看答案和解析>>
科目:初中化学 来源:陕西省西安市碑林区2014-2015学年九年级第二次模拟考试化学 题型:单选题
竹炭的吸附能力是木炭的五倍以上,其主要成分竹炭纤维的化学式为(C6H10O5)n,下列关于竹炭及竹炭纤维的说法错误的是( )
A. 竹炭属于混合物,竹炭纤维属于有机化合物
B. 利用竹炭的吸附性,可用作冰箱、鞋等的“除味剂”
C. 竹炭纤维由三种元素组成,其中氢元素的质量分数最高
D. 竹炭纤维分子中碳原子、氢原子、氧原子的个数比为6∶10∶5
C 【解析】A、竹炭属于混合物,竹炭纤维的化学式为(C6H10O5)n,属于有机化合物,说法正确;B、利用竹炭的吸附性,可用作冰箱、鞋等的“除味剂”,说法正确;C、竹炭纤维中C、H、O三种元素的质量比为12×6:1×10:16×5=36:5:40,氧元素的质量分数最高,说法错误;D、竹炭纤维中C、H、O三种元素的原子个数比为6:10:5,说法正确。故选C。查看答案和解析>>
科目:初中化学 来源:湖北省随州市2018届九年级中考模拟(3)化学试卷 题型:填空题
下图是 A、B、C三种物质的溶解度曲线。请回答:

(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是_______;
(2)当A中混有少量B时,可用 _____________方法提纯A;
(3)t2℃时,在100g水中放入_____克A物质恰好形成饱和溶液,此时溶液中溶质的质量分数为______。
C>B>A 降温结晶 60 37.5% 【解析】试题分析:分析曲线图,(1)找出t1℃时A、B、C三种物质的溶解度,比较即可;(2)A的溶解度受温度影响很大,且随温度升高而增大,降温易析出固体,而B的溶解度受温度影响小,降温不容易析出固体;(3)t2℃时A的溶解度为60g,饱和溶液的溶质质量分数为:×100% 。查看答案和解析>>
科目:初中化学 来源:江苏省苏州市2017~2018学年初三化学第二次模拟测试卷(1) 题型:选择填充题
根据物质性质,找出它对应的用途,并将字母序号填写在横线上
用途:A.制糖脱色; B.作气体肥料; C.治疗胃酸过多;D.金属表面除锈; E.改良酸性土壤; F.填充食品包装袋;
(1) CO2能与水在一定条件下光合作用:_____________;
(2) NaHCO3能与酸反应:_____________;
(3)活性炭具有吸附性:_____________;
(4)稀硫酸能与金属氧化物反应:_____________;
(5) N2化学性质不活泼:_____________;
(6)熟石灰呈碱性:_____________。
略 略 略 略 略 略 【解析】(1) CO2能与水在一定条件下光合作用,故可以做气体肥料,故选B; (2) NaHCO3能与酸反应,故可以治疗胃酸过多,故选C; (3)活性炭具有吸附性可以在制糖业中脱色,故选A; (4)稀硫酸能与金属氧化物反应,故可以用稀硫酸除锈,故选D; (5) N2化学性质不活泼可以作为食品保护气,故选F; (6)熟石灰呈碱性可以用于改良...查看答案和解析>>
科目:初中化学 来源:江苏省无锡市2018届九年级下学期月考化学试卷 题型:实验题
氧化铝(Al2O3)、氮化铝(AlN)都是一种重要的无机非金属材料,广泛应用于矿业生产和集成电路生产领域,某化学课题小组的同学在实验室里进行氮化铝的制备并测定其含量的实验。
【实验一】制备氮化铝
【资料1】实验室常用饱和亚硝酸钠与氯化铵溶液反应制取纯净的氮气。
有关反应的化学方程式为:
NaNO2+NH4Cl NaCl+N2↑+2H2O(此反应是放热反应);
Al2O3+3C+N2 高温 2AlN+3CO
试回答:
(1)氮化铝(AlN)中氮元素的化合价是 。
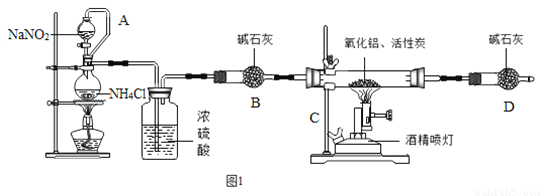
(2)加入药品前必须进行的一个实验步骤是 ,加热片刻后即可移去酒精灯,不需继续加热,其理由是 。上述实验装置中存在一些不足,请指出 。
(3)在制取氮化铝时由于反应不完全,所得氮化铝产品中的杂质除氧化铝之外,还可能含有
(填化学式)。
【实验二】氮化铝含量测定
【资料2】有关氮化铝(AlN)、氧化铝和偏铝酸钠(NaAlO2)的相关反应的化学方程式为:

①AlN+NaOH+H2O===NaAlO2+NH3↑
②Al2O3 + 2NaOH=== 2NaAlO2 + H2O
③2NaAlO2 + CO2 + 3H2O === 2Al(OH)3↓ + Na2CO3
【定性分析】
(4)步骤一:小红取C装置中少量固体样品于试管中,加足量氢氧化钠溶液,固体逐渐消失,并得到无色溶液,试管口闻到有刺激性气味的气体生成,则该样品中含有氮化铝。
步骤二:小亮继续在上述无色溶液中通人二氧化碳气体出现白色沉淀,于是他认为样品中一定还存在氧化铝。你认为小亮的结论是否正确,理由是 。
【定量测定】.
【资料3】氨气的溶解性:极易溶于水,但难溶于有机溶剂四氯化碳(CCl4)和碱性溶液等。
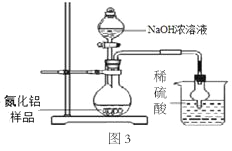
(5)图2装置通过测量氨气的体积从而测定氮化铝的含量。
小燕同学进行如下操作:(a)往广口瓶中放入适量的氮化铝样品;(b)打开分液漏斗的活塞往锥形瓶中加入过量的浓NaOH溶液;(c)检验装置气密性;(d)测定收集到X液体的体积。
正确的操作顺序为 (用a、b、c、d字母表示)。
(6)图2中X液体可能为 。
A.水 B.四氯化碳 C.氢氧化钠溶液
(7)图3装置则是通过测定吸收氨气的质量从而测定氮化铝的含量。小萍同学进行了如下操作:取氮化铝样品10.0克进行实验,实验结束后烧杯中物质增重3.4克,请你帮小萍同学计算,她取用的样品中氮化铝的质量分数是多少?
(8)图3所示方案会导致该样品中氮化铝含量测定结果偏低,为提高测定结果的精确度,在不改动装置的前提下,可采取的措施是 。
(1)-3 (2)检查装置气密性 该反应是放热反应 没有尾气处理装置(3)C(4)因为氮化铝与氢氧化钠溶液反应生成偏铝酸钠,再与二氧化碳和水反应生成氢氧化铝沉淀,所以样品中不一定有氧化铝(5)cabd(6)BC(7)82%(8)待反应结束后,从分液漏斗中通入足量的氢氧化钠溶液使残留在装置内的气体完全被稀硫酸吸收。 【解析】 试题分析:设氮化铝(AlN)中氮元素的化合价为X,则+3+X=...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com