
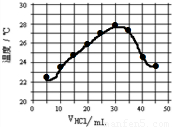
| 盐酸的体积V(mL) | 5.0 | 10.0 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 | 40.0 | 45.0 |
| NaOH的体积(mL) | 45.0 | 40.0 | 35.0 | 30.0 | 25.0 | 20.0 | 15.0 | 10.0 | 5.0 |
| 溶液温度t(℃) | 22.2 | 23.3 | 24.6 | 25.8 | 27.0 | 27.8 | 26.1 | 24.4 | 22.8 |


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:阅读理解
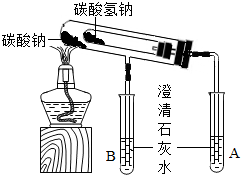 (2012?河西区二模)校兴趣小组对碳酸钠和碳酸氢钠的性质进行进研究,请你参与并完成相关问题.
(2012?河西区二模)校兴趣小组对碳酸钠和碳酸氢钠的性质进行进研究,请你参与并完成相关问题.查看答案和解析>>
科目:初中化学 来源: 题型:
 在21℃和充分搅拌下,将不同体积0.0365g/mL HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:
在21℃和充分搅拌下,将不同体积0.0365g/mL HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:| 盐酸的体积V(mL) | 5.0 | 10.0 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 | 40.0 | 45.0 |
| NaOH的体积(mL) | 45.0 | 40.0 | 35.0 | 30.0 | 25.0 | 20.0 | 15.0 | 10.0 | 5.0 |
| 溶液温度t(℃) | 22.2 | 23.3 | 24.6 | 25.8 | 27.0 | 27.8 | 26.1 | 24.4 | 22.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
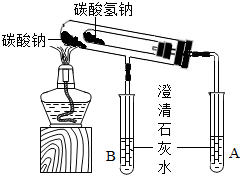 校兴趣小组对碳酸钠和碳酸氢钠的性质进一步研究,请你参与并完成相关问题.
校兴趣小组对碳酸钠和碳酸氢钠的性质进一步研究,请你参与并完成相关问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 在21℃和充分搅拌下,将不同体积0.0365g/mL HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:
在21℃和充分搅拌下,将不同体积0.0365g/mL HCl溶液和未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下:| 盐酸的体积V(mL) | 5.0 | 10.0 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 | 40.0 | 45.0 |
| NaOH的体积(mL) | 45.0 | 40.0 | 35.0 | 30.0 | 25.0 | 20.0 | 15.0 | 10.0 | 5.0 |
| 溶液温度t(℃) | 22.2 | 23.3 | 24.6 | 25.8 | 27.0 | 27.8 | 26.1 | 24.4 | 22.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com