
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学是一门富有创造性的科学.含氟物质的合成,对推动社会进步发挥着巨大作用.
化学是一门富有创造性的科学.含氟物质的合成,对推动社会进步发挥着巨大作用. ,由氟原子的结构示意图知,氟原子在化学反应中易得(填“失”或“得”)电子.
,由氟原子的结构示意图知,氟原子在化学反应中易得(填“失”或“得”)电子.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
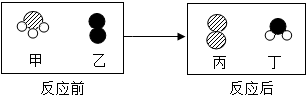
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
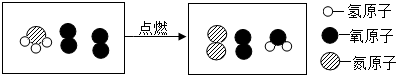
| A. | 该反应前的反应物中氮元素的化合价为-3价 | |
| B. | 该反应前后,分子的种类一定发生变化 | |
| C. | 该反应中参加反应的两种物质的质量比为17:23 | |
| D. | 该反应属于置换反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 温度(℃) | 0 | 10 | 26 | 30 |
| 水溶液 | 7.31 | 9.28 | 11.03 | 12.98 |
| 氨(8%)溶液 | 1.41 | 1.58 | 2.25 | 3.36 |
| 氨(35%)溶液 | 0.44 | 0.75 | 0.82 | 非常压 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
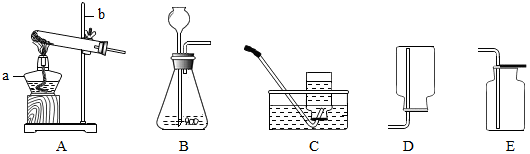
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com