
| 主要成分 | NaHCO3 | Mg(OH)2 |
| 主要成分相对分子质量 | 84 | 58 |
| 建议每次剂量/g | 0.5 | 0.3 |
分析 根据物质的性质进行分析,(1)NaHCO3能与盐酸反应生成二氧化碳,易造成胃穿孔,(2)根据药品的主要成分与盐酸的反应进行分析.(3)Mg(OH)2与胃酸作用生成氯化镁,溶液中的镁离子刺激肠道蠕动,故具有轻度腹泻作用.
解答 解:(1)NaHCO3能与盐酸反应生成二氧化碳,易造成胃穿孔,所以本题答案为:NaHCO3和HCl反应生成气态CO2,使胃内气压迅速升高,可能导致胃穿孔;
(2)设0.5g碳酸氢钠消耗盐酸的质量为x,则有
NaHCO3+HCl═NaCl+H2O+CO2↑
84 36.5
0.5g x
$\frac{84}{0.5g}$=$\frac{36.5}{x}$
x=0.22g
设0.3g氢氧化镁消耗盐酸的质量为y,则有
Mg(OH)2+2HCl═MgCl2+2H2O
58 73
0.3g y
$\frac{58}{0.3g}$=$\frac{73}{y}$
y=0.38g
通过计算可以看出,0.3gMg(OH)2比0.5gNaHCO3能中和更多的HCl,所以药效强于NaHCO3,当氢氧化镁和盐酸反应时其速率慢于碳酸氢钠和盐酸的反应.
(3)Mg(OH)2与胃酸作用生成氯化镁,溶液中的镁离子刺激肠道蠕动,故具有轻度腹泻作用.
故答案为:(1)NaHCO3和HCl反应生成气态CO2,使胃内气压骤然升高;
(2)0.3g Mg(OH)2比0.5gNaHCO3能中和更多的HCl,所以药效强于NaHCO3;Mg(OH)2和HCl反应速率慢于NaHCO3和HCl,所以药效比服用NaHCO3持久;
(3)Mg(OH)2和HCl反应生成MgCl2和H2O,出现“轻泻”和MgCl2或Mg2+有关.
点评 本题考查了化学知识在医药方面的应用,完成此题,可以依据酸和碱反应的有关知识进行.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实现现象 | 实验结论 |
① X是碳酸钠溶液 X是碳酸钠溶液 | 无明显现象 | 猜想二不正确 |
② Y是氢氧化钙溶液 Y是氢氧化钙溶液 | 产生白色沉淀 | 猜想三正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | KCl(MnO2) 溶解、过滤、洗涤、干燥 | |
| B. | CO(CO2) 通过灼热的氧化铜 | |
| C. | CO2(HCl) 通入饱和NaHCO3溶液 | |
| D. | CaO(CaCO3) 加盐酸到不再有气泡产生 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
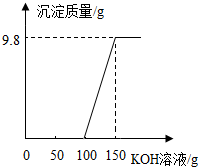 电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来一定量废水,逐滴加入KOH溶液,反应情况如图所示,请回答:
电镀厂的废水中含有H2SO4和CuSO4,为了回收CuSO4并得到化肥,工厂化验室取来一定量废水,逐滴加入KOH溶液,反应情况如图所示,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 物质的性质和用途是化学的重要研究内容.
物质的性质和用途是化学的重要研究内容.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaCl CuSO4 KNO3 | B. | AgNO3 Na2SO4 KCl | ||
| C. | K2CO3 NH4NO3 MgCl2 | D. | Al2(SO4)3 NaNO3 NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com