
| 选项 | 需要区分的物质 | 所加试剂或操作方法 |
| A | 木炭粉和二氧化锰 | ①分别点燃 ②与氧化铜混合,加热 |
| B | 食盐和白糖 | ①尝味道 ②分别溶于水 |
| C | 软水和硬水 | ①分别加适量肥皂水振荡 ②观察颜色 |
| D | 氮气和氧气 | ①用燃着的木条 ②闻气味 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、根据木炭具有可燃性和还原性分析;
B、根据食盐和白糖都易溶于水进行分析.
C、根据硬水和软水都是无色透明的液体进行分析;
D、根据氧气和氮气都是无色无味的气体进行分析.
解答 解:A、木炭具有可燃性和还原性,因此木炭能够被点燃,木炭能够还原氧化铜产生红色固体,而二氧化锰不能,可以鉴别,故选项正确;
B、食盐和白糖都易溶于水,不能鉴别,故选项错误;
C、硬水和软水都是无色透明的液体,不能鉴别,故选项错误;
D、氧气和氮气都是无色无味的气体,不能鉴别,故选项错误;
故选项为:A.
点评 本道题目考查了一些常见物质的鉴别方法,在解此类题时,首先分析被鉴别物质的性质,然后选择适当的试剂和方法,出现不同的现象即可鉴别,本题可以利用排除法较为简洁.


科目:初中化学 来源: 题型:解答题
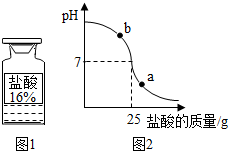
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
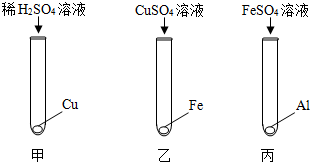
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 20.0 | 20.0 | 20.0 | 20.0 |
| 剩余固体质量/g | 17.2 | 14.4 | 13.0 | 13.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
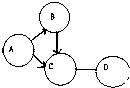 A、B、C、D、分别是过氧化氢溶液、碳、水、氧气中的一种物质,用圆圈表示这四种物质,(“-”表示两种物质之间能发生反应,“→”表示一种物质能转化为另一种物质)请回答下列问题:
A、B、C、D、分别是过氧化氢溶液、碳、水、氧气中的一种物质,用圆圈表示这四种物质,(“-”表示两种物质之间能发生反应,“→”表示一种物质能转化为另一种物质)请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com