
| A. | ①② | B. | ③④ | C. | ②③ | D. | ①④ |
分析 ①根据质量守恒定律,反应前后元素的种类不变,根据计算二氧化碳中的碳元素的质量和根据化学方程式计算,水的质量及其氢元素的质量,确定物质的组成;
②由8.8gCO2,可计算出碳元素的质量,再计算R中碳元素的质量分数;
③根据化学方程式计算,已知6.4g某物质R完全燃烧生成8.8gCO2,可计算生成的水的质量;
④根据化学方程式计算,已知6.4g某物质R完全燃烧生成8.8gCO2,可计算R的相对分子质量.
解答 解:①根据质量守恒定律,反应前后元素的种类不变:8.8g×$\frac{12}{44}$×100%=2.4g;
根据化学方程式计算,设水质量为x,
2R+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O
88 72
8.8g x
则$\frac{88}{72}=\frac{8.8g}{x}$
x=7.2g
故氢元素的质量为7.2g×$\frac{2}{18}$×100%=0.8g;
碳元素的质量+氢元素的质量=2.4+0.8<6.4,故R应由碳、氢、氧元素三种元素组成;故①错误;
②由8.8gCO2,可计算出碳元素的质量为:8.8g×$\frac{12}{44}$×100%=2.4g,再计算R中碳元素的质量分数为:$\frac{2.4g}{6.4g}$×100%=37.5%;故②正确
③根据②中计算,故③6.4gR燃烧还生成了7.2gH2O,正确;
④根据化学方程式计算,设R的相对分子质量为y,
2R+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+4H2O
2R 88
6.4g 8.8g
$\frac{2R}{88}=\frac{6.4g}{8.8g}$
解得R=32.故④R的相对分子质量等于64,错误
故选C.
点评 要求掌握并理解各元素的相对原子质量的作用;求物质中各元素的比值,计算某分子的相对分子质量,求某物质中某元素的质量分数都是基本的计算.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:初中化学 来源: 题型:实验探究题
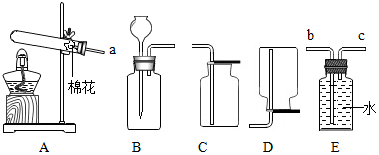 实验操作考试中为了制取氧气和二氧化碳,实验室提供了以下药品和仪器装置,请回答下列问题:
实验操作考试中为了制取氧气和二氧化碳,实验室提供了以下药品和仪器装置,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验装置 | 实验步骤 | 分析 |
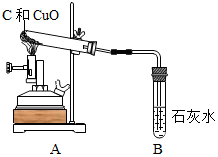 | ①检验装置气密性 | |
| ②把木炭和氧化铜的混合物放入试管,如左图所示连接实验装置 | 装置中存在的问题是B试管处不应该有橡皮塞; | |
| ③改进装置后,点燃酒精喷灯开始实验 | 装置B的作用是检验产物是否有二氧化碳; | |
| ④反应结束时,先将导管从装置B中撤出,再停止加热 | 目的是防止液体倒流引起试管炸裂; | |
| ⑤待试管冷却后将剩余固体M倒入烧杯,加入足量稀硫酸,过滤 | 得到蓝色滤液 滤渣为红色和黑色固体混合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子中原子核内的质子数和中子数一定相等 | |
| B. | 同种元素的原子和离子(如钠原子和钠离子)核内质子数一定相等 | |
| C. | 参加化学反应的各物质的分子总和与反应后生成的各物质的分子总和相等 | |
| D. | 化学反应前后,原子的种类、数目、质量都不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com