
 有一化学工厂排放的废水中含有碳酸钠和氢氧化钠,化学兴趣小组为探究废水中碳酸钠的含量,提取50g废水样品于锥形瓶中,逐滴加入7.3%的稀盐酸,反应过程中产生二氧化碳的质量与加入稀盐酸的质量如图,请计算.
有一化学工厂排放的废水中含有碳酸钠和氢氧化钠,化学兴趣小组为探究废水中碳酸钠的含量,提取50g废水样品于锥形瓶中,逐滴加入7.3%的稀盐酸,反应过程中产生二氧化碳的质量与加入稀盐酸的质量如图,请计算.分析 (1)根据图象分析判断;
(2)(3)先根据二氧化碳的质量结合化学方程式计算出废水中碳酸钠的质量和与碳酸钠反应的盐酸的质量,利用质量差即可计算出氢氧化钠消耗的盐酸质量,根据盐酸与氢氧化钠反应的化学方程式即可解答.
解答 解:(1)根据图象分析判断,生成二氧化碳的质量为:2.2g;
(2)设废水中碳酸钠的质量分数为x,需要的稀盐酸为y,生成的氯化钠的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
50g×x 7.3%y z 2.2g
$\frac{106}{50g×x}=\frac{73}{7.3%y}=\frac{117}{z}=\frac{44}{2.2g}$
x=10.6% y=50g z=5.85g
答:废水中碳酸钠的质量分数为10.6%.
(3)与氢氧化钠反应的稀盐酸质量为75-50=25g,
设氢氧化钠对应生成的氯化钠的质量为m,
NaOH+HCl=NaCl+H2O
36.5 58.5
25g×7.3% m
$\frac{36.5}{25g×7.3%}=\frac{58.5}{m}$
m=2.925g
生成的硫酸钾的质量=5.85g+2.925g=8.775g.
方法二、盐酸与氢氧化钠和碳酸钠均反应生成氯化钠,可直接根据氯化氢的质量计算氯化钠的质量,
设生成氯化钠的质量为x
HCl~~NaCl
36.5 58.5
75g×7.3% x
$\frac{36.5}{75g×7.3%}=\frac{58.5}{x}$
x=8.775g
故答案为:(1)2.2;(2)10.6%;(3)8.775.
点评 本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
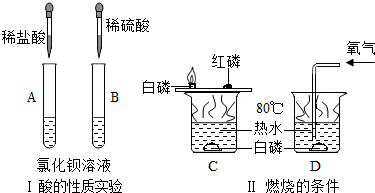
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 在金属活动性顺序中,活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来.张老师在做钠与硫酸铜溶液反应的演示实验时,观察到的现象是:钠块在液面上很快融成一个银白色小球,并四处游动,溶液中出现蓝色絮状沉淀,小球很快停在絮状沉淀集中处燃烧起来,并伴随有轻微的爆炸声,却始终没有发现在钠表面有红色固体析出.对此,同学们展开了如下探究:
在金属活动性顺序中,活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来.张老师在做钠与硫酸铜溶液反应的演示实验时,观察到的现象是:钠块在液面上很快融成一个银白色小球,并四处游动,溶液中出现蓝色絮状沉淀,小球很快停在絮状沉淀集中处燃烧起来,并伴随有轻微的爆炸声,却始终没有发现在钠表面有红色固体析出.对此,同学们展开了如下探究:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 验证石蜡在氧气中燃烧的产物,所需氧气可用排水法收集 | |
| B. | 向NaOH固体中加入稀HCl,验证中和反应放热 | |
| C. | 证明CO2与NaOH溶液反应,只要向反应后的溶液中滴加酚酞试液 | |
| D. | 用FeCl2溶液、Cu、AgNO3溶液可以证明铁、铜、银三种金属的活动性强弱 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 视黄醇属于氧化物 | |
| B. | 视黄醇的化学式中X=2 | |
| C. | 视黄醇中碳元素的质量分数约为39.2% | |
| D. | 视黄醇中碳元素与氢元素的质量比为8:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
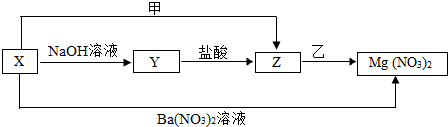
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
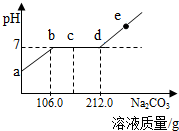 现向100.0g实验室制取CO2后的酸性废水中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法正确的是( )
现向100.0g实验室制取CO2后的酸性废水中滴加溶质质量分数为10.0%的Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法正确的是( )| A. | ab段产生白色沉淀 | |
| B. | c点对应的溶液中的溶质有2种 | |
| C. | d点对应溶液中溶质的质量为11.7g | |
| D. | 向e点溶液中滴加酚酞试液,溶液显红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com