
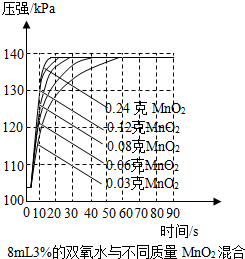
 实验室常用双氧水与二氧化锰混合来制取氧气,写出相关反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,小王同学对“双氧水分解快慢的影响因素”进行了探究.
实验室常用双氧水与二氧化锰混合来制取氧气,写出相关反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,小王同学对“双氧水分解快慢的影响因素”进行了探究.| 实验编号 | 温度℃ | 二氧化锰的形状(均取0.4cm) | 收集到氧气的体积/mL(时间均为10s) |
| ① | 20 | 颗粒状 | a |
| ② | 30 | 粉末状 | b |
| ③ | 30 | 颗粒状 | c |
| ④ | 20 | 粉末状 | d |
分析 过氧化氢在二氧化锰催化作用下分解生成水和氧气;
进行对比试验要确定好常量和变量;
根据图中提供的信息可以判断相关方面的问题.
解答 解:实验室常用双氧水与二氧化锰混合来制取氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
| 实验编号 | 温度℃ | 二氧化锰的形状(均取0.4cm) | 收集到氧气的体积/mL(时间均为10s) |
| ① | 20 | 颗粒状 | a |
| ② | 30 | 粉末状 | b |
| ③ | 30 | 颗粒状 | c |
| ④ | 20 | 粉末状 | d |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫酸铜溶液和氟化钡溶液 | B. | 氢氧化钙钡溶液和稀硝酸 | ||
| C. | 硫酸和硝酸钾溶液 | D. | 碳酸钾溶液和稀硝酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
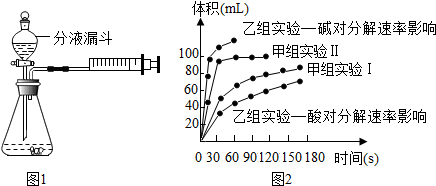
| 实验编号 | 温度 | 催化剂 | 质量分数 | |
| 甲组实验Ⅰ | 25℃ | 二氧化锰 | 10mL 2%H2O2 | |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 组合序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 组合物质 | H2SO4 NaOH | H2SO4 NaCl | H2SO4 Na2CO3 | H2SO4 Ba(NO3)2 | NaOH Ba(NO3)2 | Na2CO3 Ba(NO3)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
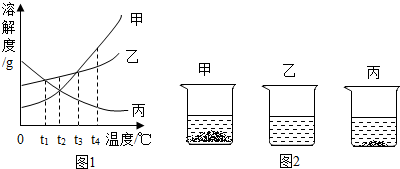
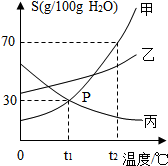 如图是甲、乙、丙三种物质(其晶体均不含结晶水)的溶解度曲线.据图回答:
如图是甲、乙、丙三种物质(其晶体均不含结晶水)的溶解度曲线.据图回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com