
| 73 |
| 2 |
| (108.2g-35.2g)×x |
| 0.2g |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:初中化学 来源: 题型:
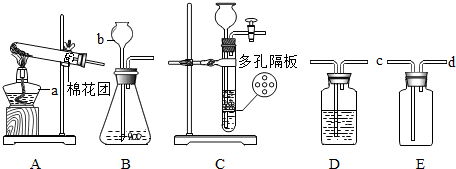
查看答案和解析>>
科目:初中化学 来源: 题型:
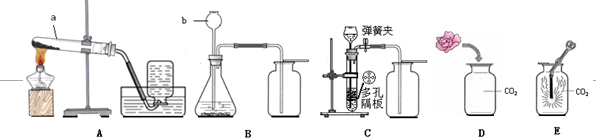
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 如何合理、高效、节约地使用煤、石油、天然气这三大当今世界最主要的化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.回答下列问题:
如何合理、高效、节约地使用煤、石油、天然气这三大当今世界最主要的化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
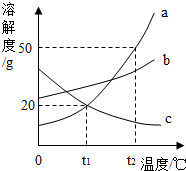 如图是a、b、c三种固体物质的溶解度曲线.
如图是a、b、c三种固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:
| A、①>②>③>④ |
| B、④>②>①>③ |
| C、④>①>③>② |
| D、②>③>④>① |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 8 | 2 | 40 | 5 |
| 反应后质量/g | 待测 | 24 | 8 | 23 |
| A、反应后X的质量为0 |
| B、Y、Q的相对分子质量比一定为11:9 |
| C、参加反应的X、Z的质量比为1:5 |
| D、该密闭容器中发生的化学变化属于分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、N2O |
| B、HNO3 |
| C、NO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com