
【题目】如图所示,A是氧化物,可作干燥剂;D是一种钠盐,用于制造玻璃,洗涤剂等,它们之间发生如图变化,请你根据所学的化学知识作出推断:
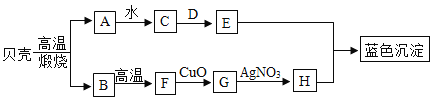
(1)A______,D______;
(2)贝壳高温煅烧的化学方程式_____;
(3)B![]() F的化学方程式_____;E+H→蓝色沉淀的化学方程式是______.
F的化学方程式_____;E+H→蓝色沉淀的化学方程式是______.
(4)反应G![]() H基本反应类型是______反应.
H基本反应类型是______反应.
【答案】CaO Na2CO3 CaCO3![]() CaO+CO2↑ CO2+C
CaO+CO2↑ CO2+C![]() 2CO 2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3 置换
2CO 2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3 置换
【解析】
根据框图,贝壳的成分是碳酸钙,高温煅烧生成氧化钙和二氧化碳,A是氧化物,可作干燥剂,所以A是氧化钙,B是二氧化碳,那C就是氢氧化钙,又D是一种盐,用于制造玻璃,洗涤剂等,故D是碳酸钠,E为氢氧化钠,二氧化碳在高温下与碳反应生成一氧化碳,故F为一氧化碳,在判断G为铜,H为硝酸铜,代入验证,推理正确。
(1)A是氧化钙,D碳酸钠,化学式为:CaO,Na2CO3;
(2)贝壳的主要成分是碳酸钙,高温分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(3)B是二氧化碳,二氧化碳在高温下与碳反应生成一氧化碳,E为氢氧化钠,H为硝酸铜,E与H反应生成氢氧化铜蓝色沉淀和硝酸钠,反应的化学方程式为:CO2+C![]() 2CO,2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3;
2CO,2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3;
(4)G为铜,与硝酸银反应生成银和硝酸铜,此反应属于置换反应。


科目:初中化学 来源: 题型:
【题目】一包不纯的Na2CO3固体,杂质可能是CuSO4、KNO3、CaCl2、NaHCO3中的一种或几种。现取该样品溶于水得到无色澄清溶液,另取样品10.6g,加入100g稀硫酸恰好完全反应,产生气体4.6g,则下列判断正确的是( )
A.样品中一定没有CuSO4、CaCl2,一定有NaHCO3
B.样品中一定含有KNO3,可能含有NaHCO3
C.样品中一定含有NaHCO3,可能含有KNO3
D.所加的稀硫酸溶质的质量分数不大于9.8%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们在学习酸碱的化学性质时构建了如图知识网络,A、B、C、D是不同类别的物质,“-”表示物质在一定条件下可以发生化学反应。请回答下列问题:
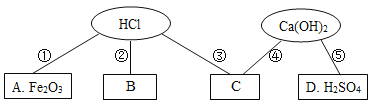
(1)B是我国年产量最多的金属,它的名称为___________。
(2)反应①的化学方程式为____________,实验现象为____________。
(3)反应④可用于工业上制烧碱,则其化学方程式为_____,基本反应类型为____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将铜、氧化铜、氢氧化铜混合粉末25g在加热条件下用氢气还原,反应完全后,测得有0.5g氢气参加了反应,同时有6.3g水生成。试计算该混合物中铜、氧化铜、氢氧化铜各多少克。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学知识就在我们身边.
(1)打开冰箱闻到一股异味,建议放一包活性炭,这是利用了活性炭的______.
(2)厨房所用的燃料是天然气,优点是______(答一点即可),其燃烧的化学方程式为_______;
(3)人们的生活离不开金属,若铁制品表面已锈蚀,请写出用盐酸除去铁锈的化学方程式为_______.
(4)人们的生活离不开燃烧,可燃物燃烧除需要氧气外,还需要满足的条件是____;煤块粉碎后,在空气中燃烧得更快、更充分,这是因为_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向某硫酸和硫酸铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是
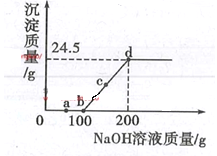
A.a点溶液中含有两种溶质
B.bc段发生反应的类型为置换反应、
C.根据图中收据计算出氢氧化钠溶液的浓度
D.d点浓液中主要存在的离子为Na+、Cu2+、OH-、SO42-
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铜片在空气中久置表面会变绿。某小组同学设计并进行实验,探究铜变绿的条件。
(查阅资料)(1)、铜绿的成分是碱式碳酸铜![]() ,碱式碳酸铜能够与盐酸反应。
,碱式碳酸铜能够与盐酸反应。
(2)、浓硫酸具有吸水性,可以作为一些气体的干燥剂。
(猜想与假设)常温下,铜片变绿可能与![]() 、
、![]() 、水蒸气有关。
、水蒸气有关。
(进行实验)利用下图1装置分别制取并收集气体于试管中,制取气体原理及收集气体等操作见下表。将收集好的气体,用图2所示装置进行4个实验,通过控制与铜片接触的物质,进行实验并持续观察实验现象。
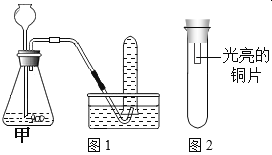
编号 | 主要实验操作 | 实验现象 |
1 | 甲中盛有过氧化氢溶液和二氧化锰,收集一试管气体 | 铜片始终无明显变化 |
2 | 甲中盛有大理石和稀盐酸,收集一试管气体 | 铜片始终无明显变化 |
3 | 甲处先用过氧化氢溶液和二氧化锰反应收集半试管气体,再换盛有大理石和稀盐酸的装置,继续收集至一试管气体 | 一段时间后铜片变绿 |
4 | 甲处先用过氧化氢溶液和二氧化锰反应收集半试管气体,再换盛有大理石和稀盐酸的装置,继续收集至一试管气体,并向气体中加入适量浓硫酸 | 铜片始终无明显变化 |
(解释与结论)
(1)实验1的目的是验证______。
(2)实验2制取气体反应的化学方程式为______。
(3)得出“铜片变绿一定与![]() 有关”的结论,依据的两个实验是______
有关”的结论,依据的两个实验是______![]() 填编号
填编号![]() 。
。
(4)实验4中,试管内的气体主要含有______。
(5)上述实验可推知,铜片变绿的条件是______。
(讨论与交流)
(6)同学们猜想碱式碳酸铜与盐酸反应有二氧化碳生成,证明此猜想所需试剂是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小宇为了测定实验室中氯酸钾样品的纯度,取10g样品与1g二氧化锰混合,依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 9.68 | 9.04 | 7.16 | 7.16 |
试计算:
(1)完全反应后产生的氧气的总质量为_____________g;
(2)样品中氯酸钾的纯度是____(写出计算过程)
(3)加热时间t1后,9.68g剩余固体中除杂质外还含有的物质为_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
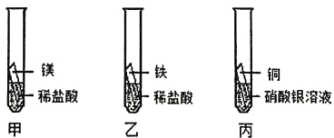
【题目】某兴趣小组为探究 Mg、Fe、Cu、Ag 四种金属的活动性进行如下实验。(注:所用金属大小形状相同、酸的体积浓度相同)
![]()
①甲、乙试管中的实验现象为_______,依据甲乙试管中产生此现象的速率甲大于乙,可知活动性 Mg___Fe(填“>”、“=”或“<”);
②根据丙中现象_____________,可知活动性 Cu>Ag;
③小组同学随后发现该实验无法得出四种金属的活动性顺序,于是补充图丁试管中实验,最终得出四种金属活动性:Mg>Fe>Cu>Ag,则补充实验中的试剂A、B 分别为____________
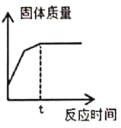
④为了减少环境污染,小组同学将乙中剩余的铁加入丙溶液中回收丙溶液溶质的金属,至t时间后固体质量不再变化,根据上图所示溶液中固体质量变化情况,分析最后所得固体的成分为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com