
| 实验步骤 | 实验现象 | 实验结论 |
| 1.取样品少量于小烧杯中,加入适量水,充分搅拌,过滤.得滤液A和滤渣B | / | / |
| 2.取少量滤渣A于试管中,加适量稀盐酸 | 大量气泡产生 | 氢氧化钙已经变质. |
| 3.取少量滤液B于试管中,滴加无色酚酞试液 | 变红 | 确证氢氧化钙部分变质. |
| 加入盐酸的质量/g | 0 | 25 | 37.5 |
| 锥形瓶中物质的质量/g | 45 | 70 | 80.3 |
分析 (2))猜想与假设:氢氧化钙变质后,生成碳酸钙;
(3)设计方案、氢氧化钙变质后,生成碳酸钙,碳酸钙难溶于水,而氢氧化钙微溶于水.所以我们可以根据是否溶于水,来推断是否变质.根据碳酸钙能与盐酸反应生成二氧化碳气体,然后根据是否有气体产生来判断是否变质生成碳酸钙.根据氢氧化钙与二氧化碳能反应生成沉淀判定粉末中是否还有未变质的氢氧化钙;
(4)联想与启示:氢氧化钙变质是由于Ca(OH)2与空气中的二氧化碳发生化学反应的缘故,因此氢氧化钙应密封保存;
(5)向氢氧化钙和碳酸钙的化合物中加入稀盐酸时,稀盐酸先和氢氧化钙反应生成氯化钙和水,氢氧化钙完全反应后,稀盐酸再和碳酸钙反应生成氯化钙、水和二氧化碳;
根据二氧化碳的质量可以计算碳酸钙的质量,进一步可以计算氢氧化钙的质量及其氢氧化钙的质量分数.
解答 (2)猜想与假设:氢氧化钙变质后,生成碳酸钙.故有三个可能:①氢氧化钙;②氢氧化钙、碳酸钙;③碳酸钙;
(3)设计方案:氢氧化钙变质后,生成碳酸钙,碳酸钙难溶于水,而氢氧化钙微溶于水.所以我们可以根据是否溶于水,来推断是否变质.根据碳酸钙能与盐酸反应生成二氧化碳气体,然后根据是否有气体产生来判断是否变质生成碳酸钙.根据氢氧化钙与二氧化碳能反应生成沉淀判定粉末中是否还有未变质的氢氧化钙;
(4)联想与启示:氢氧化钙变质是由于Ca(OH)2与空气中的二氧化碳发生化学反应的缘故,因此氢氧化钙应密封保存.
(5)加入盐酸的质量在0-25g时,反应前质量=45g+25g=70g,反应后质量仍然是70g,反应前后物质质量不变,说明是氢氧化钙和稀盐酸反应;
根据上表可知生成二氧化碳的质量为(12.4g+32.6g+37.5g)-80.3g=2.2g;
设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 2.2g
$\frac{100}{x}=\frac{44}{2.2g}$ x=5g
则氢氧化钙的质量为12.4g-5g=7.4g
所以此样品中氢氧化钙的质量是7.4g,碳酸钙的质量是5g.
故答案为:①碳酸钙 ②加适量稀盐酸 ③合理即滴加无色酚酞试液可 ④变红 ⑤CO2+Ca(OH)2=H2O+CaCO3↓
⑥密封 ⑦Ca(OH)2
(Ⅰ)氢氧化钙
(II)氢氧化钙:7.4g 碳酸钙 5g
点评 氢氧化钙能与二氧化碳反应生成碳酸钙,而氢氧化钙微溶于水,而碳酸钙难溶于水.但碳酸钙能溶于酸.利用氢氧化钙与碳酸钙性质的不同,设计实验鉴别两物质是否存在是本题的一个重要考查内容.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图:为测定水的组成实验装置,根据观察到的实验现象回答:
如图:为测定水的组成实验装置,根据观察到的实验现象回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | N2 | O2 | 将气体缓缓通过足量的灼热铜网 |
| B | CaO固体 | CaCO3 | 溶解,过滤,洗涤,干燥 |
| C | Cu(NO3)2溶液 | AgNO3 | 加入足量铜粉,充分反应后过滤 |
| D | CaCl2溶液 | HCl | 加入足量碳酸钙粉末,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 下列数据是硝酸钾固体在不同温度时的溶解度.
下列数据是硝酸钾固体在不同温度时的溶解度.| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量反应后的溶液于试管中, 加入碳酸钠溶液 振荡 | 有气泡产生 | 反应后盐酸有剩余. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
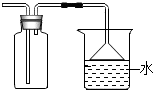 如图为某实验时收集二氧化硫气体的装置中,根据此收集装置不能推断出SO2可能具有的性质( )
如图为某实验时收集二氧化硫气体的装置中,根据此收集装置不能推断出SO2可能具有的性质( )| A. | 污染性气体 | B. | 密度比空气大 | ||
| C. | 在空气中易形成酸雨 | D. | 易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com