
【题目】某课外活动小组的同学在实验室做锌和浓硫酸反应的实验。(其反应方程式![]() )甲同学认为产生的气体中只有SO2,乙同学认为除SO2外,还可能有H2.为了验证甲、乙两同学的判断,他们设计了如图所示的装置(设锌与浓硫酸共热时产生的气体为X气体发生装置已略去)
)甲同学认为产生的气体中只有SO2,乙同学认为除SO2外,还可能有H2.为了验证甲、乙两同学的判断,他们设计了如图所示的装置(设锌与浓硫酸共热时产生的气体为X气体发生装置已略去)
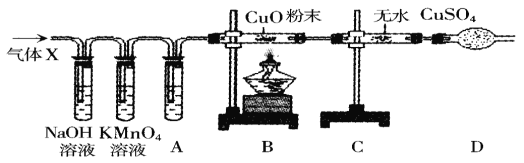
已知二氧化硫可以与高锰酸钾溶液反应,溶液会褪色。
(1)NaOH溶液的作用是(用化学方程式表示)_____。高锰酸钾溶液的作用是_____。
(2)乙同学认为还可能产生氢气的理由是_____。
(3)A中盛装的溶液是_____,其作用是_____。
(4)可以证明气体X中含有H2的实验现象是:_____。
【答案】2NaOH+SO2=Na2SO3+H2O 证明二氧化硫被氢氧化钠溶液完全吸收 锌和浓硫酸反应产生SO2和H2O,硫酸浓度变稀,一段时间后成为稀硫酸,与锌反应生成H2 浓硫酸 吸收水分 B中黑色粉末变红,C中硫酸铜粉末变蓝
【解析】
(1)氢氧化钠能够与二氧化硫反应生成亚硫酸钠和水,此处氢氧化钠溶液的作用是吸收二氧化硫,故反应的化学方程式写为:2NaOH+SO2=Na2SO3+H2O;
二氧化硫可以与高锰酸钾溶液反应,溶液会褪色,前面的氢氧化钠溶液用来吸收二氧化硫,所以高锰酸钾溶液用来证明二氧化硫被氢氧化钠溶液完全吸收,故填证明二氧化硫被氢氧化钠溶液完全吸收。
(2)锌和浓硫酸反应产生SO2和H2O,硫酸浓度变稀,一段时间后成为稀硫酸,稀硫酸与锌反应生成H2,故填锌和浓硫酸反应产生SO2和H2O,硫酸浓度变稀,一段时间后成为稀硫酸,与锌反应生成H2。
(3)为避免气体中的水对实验产生干扰,需要对反应前的气体进行干燥,装置A中盛放干燥剂,由图可知,该干燥剂是浓硫酸,故填浓硫酸;
浓硫酸具有吸水性,能够吸收气体中的水分,使气体变干燥,故填吸收水分。
(4)气体中含有氢气,则氢气与氧化铜在高温的条件下反应生成铜和水,观察到的现象是B中粉末由黑变红,反应后的气体通过装置C时,水与无水硫酸铜反应生成硫酸铜晶体,观察到的现象是C中硫酸铜粉末变蓝,故填B中黑色粉末变红,C中硫酸铜粉末变蓝。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述正确的是
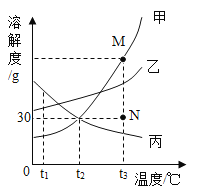
A.t1℃时, 等质量的甲、乙溶液中所含溶质的质量为乙>甲
B.t2℃时,20g 丙能溶解于50g水中形成70g溶液
C.若要将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.将t3℃时甲、乙、丙三种物质的饱和溶液降温至t2℃,所得溶液溶质质量分数的大小关系为乙>甲=丙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用下图所示装置进行实验。下列现象能证明空气中 O2 含量的是
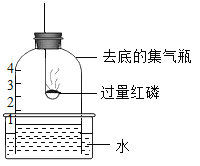
A.水槽中液面下降
B.瓶中液面最终上升至1处
C.红磷燃烧,产生白烟
D.瓶中液面先下降,后上升
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知酸式盐可以和碱发生化学反应,如:![]() 。有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,把它们溶于足量的水中,充分反应后,溶液中Ca2+、CO32-、HCO3-均转化为沉淀,将反应容器内水分蒸干,最后得到白色固体物质共29g,则原混合物中含Na2CO3的质量是( )
。有Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,把它们溶于足量的水中,充分反应后,溶液中Ca2+、CO32-、HCO3-均转化为沉淀,将反应容器内水分蒸干,最后得到白色固体物质共29g,则原混合物中含Na2CO3的质量是( )
A.10.6g
B.5.3g
C.15.9g
D.无法确定
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列所示的图像能反映相对应实验的是( )
A.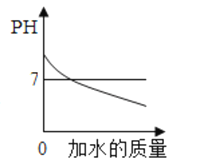 向pH=12的Ca(OH)2溶液中不断加水稀释
向pH=12的Ca(OH)2溶液中不断加水稀释
B. 向碳酸钙固体中逐滴加入稀盐酸至过量
向碳酸钙固体中逐滴加入稀盐酸至过量
C. 在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
在40℃,将饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D. 将足量的金属镁片和锌片分别和等质量的相同质量分数的稀硫酸混合
将足量的金属镁片和锌片分别和等质量的相同质量分数的稀硫酸混合
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】M、N两种物质的溶解度曲线如图所示。t2℃时往一杯100g水中加入质量都是ag的M和N两种物质(假设两种物质的溶解性互不影响),制成混合物。将该混合物的温度降低到tl℃,下列说法正确的是( )
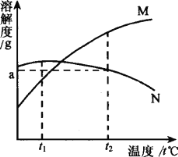
A.t2℃温度下,得到的溶液中溶质M、N的质量分数都为a%
B.温度降低到t1℃时,溶液中两种物质均饱和
C.如果温度升高,溶液中将析出N的晶体,溶质M的质量分数保持不变,溶质N的质量分数将减小
D.温度降到t1℃时,溶液中N的质量分数大于M的质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以化合价为纵坐标,物质的类别为横坐标所绘制的图像叫价类图。如图为硫的价类图,请分析该图后填空:
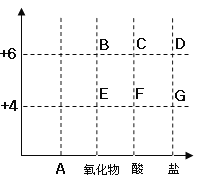
(1)E点表示的是二氧化硫,写出他的一条物理性质_____。
(2)图中可表示K2SO3这种盐的点是_____(填字母);
(3)A点表示的物质类别是_____。
(4)写出由D点表示的化合物与氢氧化钠溶液反应的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学想在实验室里用NaOH溶液制取Na2CO3溶液。
查阅资料:①CO2通入NaOH溶液时极易因CO2过量而产生NaHCO3,且无明显现象
②NaHCO3溶液煮沸时不会发生分解
③![]()
④Ca(HCO3)2可溶于水
制取步骤:①量取两份50mL相同浓度的NaOH溶液备用;
②用一份50mLNaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
③小心煮沸②溶液1~2分钟;
④_____,即得Na2CO3溶液。
实验探究:为了检验制得的溶液是否为纯净的Na2CO3溶液,请你与该同学一起完成下列实验探究:
实验步骤 | 实验现象 | 实验结论 | |
取少量制得的溶液于试管中,加入过量的_____溶液 | 产生白色沉淀 | 原来溶液含有Na2CO3 | |
将上步实验所得混合物进行过滤,将滤液分成两份 | 取其中一份加入足量的_____ | 无气泡产生 | 原来制得的溶液中不含_____ |
取另一份加入MgCl2溶液 | _____ | 原来制得的溶液中不含NaOH | |
结论:所制得的溶液为纯净的Na2CO3溶液
评价与反思:有人认为实验步骤③④的顺序对调,即先混合,再煮沸,更合理。你认为对吗?_____请说明理由:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:
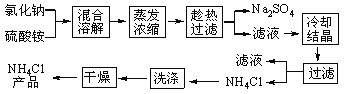
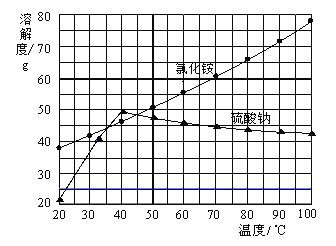
氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需NaCl_____g。
(2)实验室进行蒸发浓缩用到的主要仪器有_____、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为_____。
(4)不用其他试剂,检查NH4Cl产品是否纯净的方法及操作是_____。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com