��I���������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO
2�ĺ�������Ч�ؿ�������CO
2�������˸������ձ����ӡ�
��1��Ŀǰ���ó��ٽ�CO
2����״̬������̬��Һ̬֮�䣩���������������ѳ�Ϊһ�����ƣ���һ�����Ի����Ļ�����������
��
��2����CO
2ת�����л������Чʵ��̼ѭ����CO
2ת�����л�������Ӻܶ࣬�磺

���Ϸ�Ӧ�У�����ܵ���
��ԭ����������ߵ���
��
��3��Ϊ̽����CO
2������ȼ�ϼ״��ķ�Ӧԭ�����ֽ�������ʵ�飺
�����Ϊ1L���ܱ������У�����1molCO
2��3molH
2��һ�������·�����Ӧ��
CO
2��g��+3H
2��g��

CH
3OH��g��+H
2O��g����H=��49.0kJ/mol
���CO
2��CH
3OH��g����Ũ����ʱ��仯��ͼ��ʾ��

�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H
2��=
���������������� ��
�ڸ÷�Ӧ��ƽ�ⳣ������ʽΪ
�������¶ȣ�ƽ�ⳣ������ֵ��
�����������С�����䡱����
�����д�ʩ����ʹn��CH
3OH��/n��CO
2���������
.
| A�������¶� | B������He��g����ʹ��ϵѹǿ���� |
| C����H2O��g������ϵ�з��� | D���ٳ���1molCO2��3molH2 |
��II�������Ǻϳɰ�����Ҫԭ�ϣ��ϳɰ���Ӧ���Ȼ�ѧ����ʽ���£�
N
2��g��+3H
2��g��

2NH
3��g�� ��H=-93.4kJ/mol
�ٵ��ϳɰ���Ӧ�ﵽƽ��ı�ijһ������������ı�N
2��H
2��NH
3����������Ӧ������ʱ��Ĺ�ϵ����ͼ��ʾ��


ͼt
1ʱ����ƽ���ƶ�������������
��
���б�ʾƽ��������NH
3������ߵ�һ��ʱ����
��
���¶�ΪT��Cʱ����3amolH
2��amolN
2������ͼ��ʾ���ܱ������У�������������������ƶ�����ַ�Ӧ����N
2��ת����Ϊ50%���������ͬ�¶��½�3amolH
2��amolN
2��2amolNH
3�������������У�ƽ��ʱH
2���������Ϊ
��

 ����ͼ��ʾ���ܱ���������һ������������������磬���ܷ��Ծ��Կɿ������������������
����ͼ��ʾ���ܱ���������һ������������������磬���ܷ��Ծ��Կɿ������������������

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�

 CH3OH��g��+H2O��g����H=��49.0kJ/mol
CH3OH��g��+H2O��g����H=��49.0kJ/mol
 2NH3��g�� ��H=-93.4kJ/mol
2NH3��g�� ��H=-93.4kJ/mol

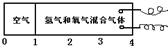 ����ͼ��ʾ���ܱ���������һ������������������磬���ܷ��Ծ��Կɿ������������������
����ͼ��ʾ���ܱ���������һ������������������磬���ܷ��Ծ��Կɿ������������������ �������У�
�������У� �IJ��ֳ���ǿ�������
�IJ��ֳ���ǿ������� �IJ��ֳ����H2��O2�Ļ�����壻�������õ��ȼ����ʱ�������ȱ��嵽��ߣ����������ڵ������ָ���ԭ�����¶�ʱ�������������ұ��ƶ�������ͣ�������ݻ���
�IJ��ֳ����H2��O2�Ļ�����壻�������õ��ȼ����ʱ�������ȱ��嵽��ߣ����������ڵ������ָ���ԭ�����¶�ʱ�������������ұ��ƶ�������ͣ�������ݻ��� ������ԭ��������������������ȿ�����
������ԭ��������������������ȿ�����
 ��������
�������У� �IJ��ֳ���ǿ�������
�IJ��ֳ���ǿ������� �IJ��ֳ����H2��O2�Ļ�����壻�������õ��ȼ����ʱ�������ȱ��嵽��ߣ����������ڵ������ָ���ԭ�����¶�ʱ�������������ұ��ƶ�������ͣ�������ݻ���
�IJ��ֳ����H2��O2�Ļ�����壻�������õ��ȼ����ʱ�������ȱ��嵽��ߣ����������ڵ������ָ���ԭ�����¶�ʱ�������������ұ��ƶ�������ͣ�������ݻ��� ������ԭ��������������������ȿ����ǣ� ��
������ԭ��������������������ȿ����ǣ� ��