
| A. | H2O、AgNO3、HNO3 | B. | H2O、NaOH、HNO3 | C. | H2O、NaOH、HCl | D. | H2O、KOH、HNO3 |
分析 根据BaSO4难溶于水,氯化钠、氯化铁易溶于水,氯化铁能与氢氧化钠溶液反应生成氢氧化铁沉淀和氯化钠,氢氧化铁能与稀盐酸反应生成氯化铁和水,进行分析解答.
解答 解:A、BaSO4难溶于水,NaCl、氯化铁均易溶于水,可加水溶解,再进行过滤,分离出BaSO4;但NaCl、氯化铁均能与硝酸银溶液反应,不能分离出NaCl、氯化铁,故选项错误.
B、BaSO4难溶于水,NaCl、氯化铁均易溶于水,可加水溶解,再进行过滤,分离出BaSO4;然后滴加适量的氢氧化钠溶液,氯化铁能与氢氧化钠溶液反应生成氢氧化铁沉淀和氯化钠,氢氧化铁沉淀与硝酸反应生成硝酸铁和水,引入了新的杂质硝酸铁,故选项错误.
C、BaSO4难溶于水,NaCl、氯化铁易溶于水,可加水溶解,再进行过滤,分离出BaSO4;然后滴加适量的氢氧化钠溶液,氯化铁能与氢氧化钠溶液反应生成氢氧化铁沉淀和氯化钠,再进行过滤,分离出氯化钠溶液和氢氧化铁沉淀;最后向氢氧化铁沉淀中滴加稀盐酸,氢氧化铁能与稀盐酸反应生成氯化铁和水;能将固体混合物逐一分离,故选项正确.
D、BaSO4难溶于水,NaCl、氯化铁易溶于水,可加水溶解,再进行过滤,分离出BaSO4;然后滴加适量的氢氧化钾溶液,氯化铁能与氢氧化钾溶液反应生成氢氧化铁沉淀和氯化钾,引入了新的杂质氯化钾,故选项错误.
故选:C.
点评 本题难度不大,考查物质的分离,熟练掌握酸碱盐的化学性质并能灵活运用是正确解答本题的关键,解题时要注意反应后不能引入新的杂质.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 洗涤用品 | 去污粉 | 洁厕灵 | 炉具清洁剂 |
实物图 |  |  |  |
| 主要成分 | 碳酸氢钠 | 盐酸 | 氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
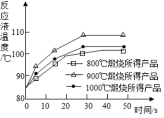
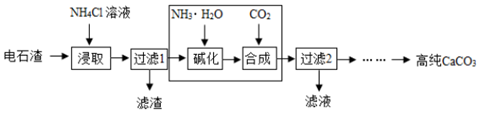
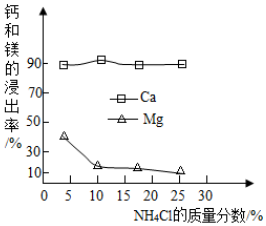
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 饱和溶液恒温蒸发部分溶剂后溶质的质量分数一定不变 | |
| B. | 同种溶质的饱和溶液一定比它的不饱和溶液溶质的质量分数大 | |
| C. | 饱和溶液转化为不饱和溶液溶液的质量一定增大 | |
| D. | 不饱和溶液转化为饱和溶液溶质的质量分数一定变大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 中国科学技术馆的“探索与发现”展厅中,在“物质之妙”主题展区有一台分子运动模拟器(如图所示).这件展品是由玻璃罩内小球的情况来表现固、液、气三态中分子的状态.当向前推动滑竿,温度升高时,玻璃罩中的小球将( )
中国科学技术馆的“探索与发现”展厅中,在“物质之妙”主题展区有一台分子运动模拟器(如图所示).这件展品是由玻璃罩内小球的情况来表现固、液、气三态中分子的状态.当向前推动滑竿,温度升高时,玻璃罩中的小球将( )| A. | 运动加快 | B. | 质量变大 | C. | 间隔变小 | D. | 数量增多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com