
| A. | S--诱抗素由三种元素组成 | |
| B. | S--诱抗素属于有机物 | |
| C. | S--诱抗素中碳、氢、氧三种元素的质量比为45:5:16 | |
| D. | S--诱抗素中含有15个氢原子 |
科目:初中化学 来源: 题型:解答题
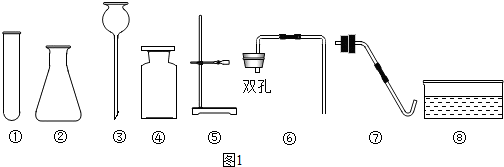
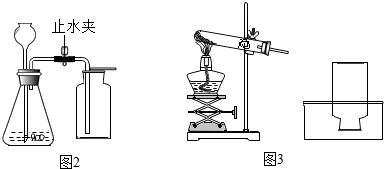
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
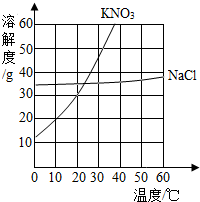 如图是KNO3和NaCl溶解度曲线,根据如图所指,回答下列问题
如图是KNO3和NaCl溶解度曲线,根据如图所指,回答下列问题查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
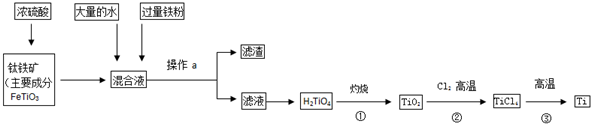
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 卟啉铁中含有6种元素 | B. | “缺铁性贫血”中的“铁”指单质铁 | ||
| C. | 人体补铁的唯一方法是服用卟啉铁 | D. | 1个卟啉铁分子中含有75个原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com