已知CuO被C还原的产物可以是Cu,也可以是Cu2O(红色).现有CuO和木炭粉组成的混合物4.24g,在高温下充分反应后,剩余固体混合物呈红色(CuO全部被还原),质量为3.36g;若反应后产生的气体能全部被过量的澄清的石灰水吸收,得沉淀2.00g.
试通过计算指出所得固体产物的组成及质量分数.
解:根据元素守恒可知:4.24g混合物中碳的质量=2.00g×碳酸钙中碳的质量分数=2.00g×

=0.24g,所以该混合物中氧化铜的质量为4.24g-0.24g=4g;
若氧化铜全部被还原成铜,则铜的质量=4g×氧化铜中铜的质量分数=4g×
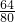
=3.20g,故剩余固体混合物3.36g一定是铜与氧化亚铜的混合物;
因为混合物减去铜的质量等于混合物中氧元素的质量,所以3.36g混合物中氧元素的质量=3.36g-3.2g=0.16g,该氧元素等于氧化亚铜中的氧元素;
所以氧化亚铜的质量为:

=
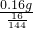
=1.44g
则所得固体中氧化亚铜的质量分数为:
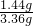
×100%≈42.9%,所以铜的质量分数为1-42.9%=57.1%;
答:所得固体产物是由铜和氧化亚铜组成,其质量分数分别为57.1%和42.9%;
分析:根据质量守恒的观点可知生成的碳酸钙中碳元素的质量应该等于4.24g混合物中碳的质量,故可计算出氧化铜的质量,进而利用化学式计算出铜元素的质量,用此数据与剩余的固体3.36g进行比较,可知该固体剩余物不可能是铜,所以应该是铜与氧化亚铜的混合物,由于该混合物减去铜的质量等于混合物中氧元素的质量,所以可依据氧的质量以及氧化亚铜的化学式计算出氧化亚铜的质量,据此解答即可.
点评:此题是一道较为复杂的化学计算题,解法可能有多种,但利用元素守恒的观点可对问题进行简化处理,估计此题会出现在竞赛的题目之列;

 =0.24g,所以该混合物中氧化铜的质量为4.24g-0.24g=4g;
=0.24g,所以该混合物中氧化铜的质量为4.24g-0.24g=4g;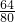 =3.20g,故剩余固体混合物3.36g一定是铜与氧化亚铜的混合物;
=3.20g,故剩余固体混合物3.36g一定是铜与氧化亚铜的混合物; =
=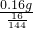 =1.44g
=1.44g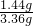 ×100%≈42.9%,所以铜的质量分数为1-42.9%=57.1%;
×100%≈42.9%,所以铜的质量分数为1-42.9%=57.1%;
