
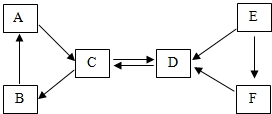
 现有A-F六种常见物质,其中B是食品包装中常用的干燥剂氧化钙,A.B、C三种白色固体都含有同种金属元素,E是固体单质,D、E、F都含有同种非金属元素.它们的转化关系如图所示.请回答:
现有A-F六种常见物质,其中B是食品包装中常用的干燥剂氧化钙,A.B、C三种白色固体都含有同种金属元素,E是固体单质,D、E、F都含有同种非金属元素.它们的转化关系如图所示.请回答:分析 根据A-F六种常见物质,B是食品包装中常用的干燥剂,所以B是氧化钙,A、B、C三种白色固体都含有同种金属元素,依据A、B、C的转化关系,可推断A、C为氢氧化钙或碳酸钙,而C会转化成CaO,可断定C为碳酸钙,所以A为氢氧化钙,再由C(碳酸钙)、D两种物质相互转化的关系,可推断出D为二氧化碳,题中说明E为固体单质,D、E、F都含有同种非金属元素,依据D(二氧化碳)、E(单质)、F的转化关系,可以判断:E为单质碳,F为一氧化碳,然后进行验证即可.
解答 解:(1)A-F六种常见物质,B是食品包装中常用的干燥剂,所以B是氧化钙,A、B、C三种白色固体都含有同种金属元素,依据A、B、C的转化关系,可推断A、C为氢氧化钙或碳酸钙,而C会转化成CaO,可断定C为碳酸钙,所以A为氢氧化钙,再由C(碳酸钙)、D两种物质相互转化的关系,可推断出D为二氧化碳,题中说明E为固体单质,D、E、F都含有同种非金属元素,依据D(二氧化碳)、E(单质)、F的转化关系,可以判断:E为单质碳,F为一氧化碳,经过验证,推导正确,所以A是Ca(OH)2,B是CaO,C是C;
(2)B→A的反应是氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2.
故答案为:(1)Ca(OH)2,CaO,C;
(2)CaO+H2O=Ca(OH)2.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe2O3具有氧化性 | B. | Fe2O3发生氧化反应 | ||
| C. | CO是氧化剂 | D. | 反应前后固体质量不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用10mL量筒量取了7.5mL水 | |
| B. | 用广泛PH试纸测得某地水的PH为5.2 | |
| C. | 测得某粗盐中氯化钠的质量分数为90.5% | |
| D. | 用托盘天平称得某小苏打样品的质量为16.7克 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com