现有硫酸镁和硫酸钠的混合物12.8g,全部溶于50g水中,加入一定量的氢氧化钠溶液,恰好完全反应生成5.8g沉淀,过滤后,所得溶液中溶质的质量分数为16.7%.试计算:
(1)原混合物中硫酸镁的质量分数;
(2)所加氢氧化钠溶液中溶质的质量分数.
解:设原混合物中硫酸镁的质量分数为x,氢氧化钠溶液中氢氧化钠的质量为y,反应生成的硫酸钠的质量为z.
MgSO
4+2NaOH═Mg(OH)
2↓+Na
2SO
4120 80 58 142
x y 5.8g z
102:58=x:5.8g x=12g
80:58=y:5.8g y=8g
142:58=z:5.8g z=14.2g
(1)原混合物中硫酸镁的质量分数为
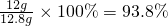
(2)反应后所得溶液的质量为
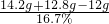
=89.8g
所加氢氧化钠溶液中溶质的质量分数为:
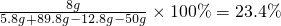
或其它合理答案过程均给分
分析:(1)运用硫酸镁和氢氧化钠反应生成氢氧化镁沉淀和硫酸钠的化学方程式计算.
(2)运用硫酸镁和氢氧化钠反应的化学方程式求出氢氧化钠和硫酸钠的质量,硫酸钠的质量除以硫酸钠溶液溶质质量分数求出硫酸钠溶液的质量,硫酸钠溶液的质量加上沉淀减去12.8g再减去50g就是氢氧化钠溶液的质量,再根据溶质质量分数计算公式求解即可解答.
点评:本题考查根据化学方程式的计算,解题的关键是根据质量守恒定律求出所加入的氢氧化钠溶液的质量.

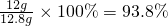
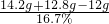 =89.8g
=89.8g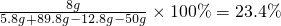


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案