
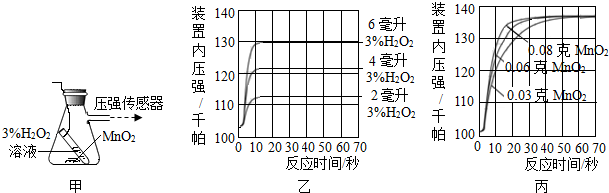

分析 (1)过氧化氢在二氧化锰的催化作用下生成水和氧气;
(2)根据图示可以看出H2O2的用量越多,产生的氧气越多;
(3)根据图中给出的比例分析.
解答 解:过氧化氢在二氧化锰的催化作用下生成水和氧气,其中二氧化锰起到催化作用;
(2)根据图示可以看出H2O2的用量越多,产生的氧气越多;
(3)由图示可知3%H2O2溶液8毫升与0.08克MnO2混合,分解速度达到实验要求,若MnO2的质量有4克需要3%H2O2溶液为$\frac{4g}{0.08g}$×8mL=400mL.
故答案为:(1)催化;
(2)H2O2的用量越多,产生的氧气越多;
(3)C.
点评 本题通过对比实验结果的分析,找到事物的内在联系,考查了学生分析问题的能力,同时也是对影响反应速率因素这一知识点的重点考查.


科目:初中化学 来源: 题型:推断题
 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶解于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加盐酸,现象如图所示(ABC表示沉淀变化,OBC表示气体变化).
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶解于水,有白色沉淀产生;过滤后,向该白色沉淀中滴加盐酸,现象如图所示(ABC表示沉淀变化,OBC表示气体变化).查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验端号 | 铝铜合金的质量(g) | 加入稀硫酸的质量 | 生成H2的质量(g) |
| 实验1 | 30 | 392 | 2 |
| 实验2 | 30 | 588 | 3 |
| 实验3 | 30 | 600 | 2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com