
【题目】如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
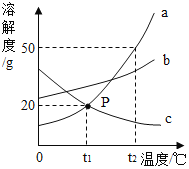
A. P点表示t1℃时,a、c饱和溶液中溶质质量相等
B. t2℃时,将30ga物质加入到50g水中充分搅拌,得到80ga的饱和溶液
C. t2℃时等质量的三种饱和溶液降温至t1℃,所得溶液中溶剂质量c>b>a
D. 将t1℃时a、b、c三种物质的溶液分别升温至t2℃,其溶质质量分数都不可能发生变化
【答案】C
【解析】
根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
A、P点表示t1℃时,a、c两种物质的溶解度相等,饱和溶液的质量不能确定,溶液中溶质质量不能确定,故A错误;B、t2℃时,a物质的溶解度是50g,t2℃时,100g水中最多溶解50ga,将30g a物质加入到50g水中充分搅拌,只能溶解25ga,得到75g a的饱和溶液,故B错误;C、t2℃时,a物质的溶解度最大,b物质次之,c物质最小,所以等质量的三种饱和溶液中,溶液中溶剂质量c>b>a,降温至t1℃,溶剂质量不变,所得溶液中溶剂质量c>b>a,故C正确;D、将t1℃时a、b、c三种物质的溶液分别升温至t2℃,c物质会析出晶体,溶质质量分数减小,故D错误。故选C。


科目:初中化学 来源: 题型:
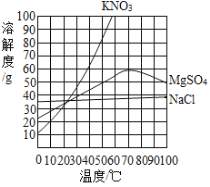
【题目】粗盐中除NaCl外还含有MgSO4以及泥沙等杂质。初步提纯粗盐的实验流程及相关物质的溶解度曲线如下图所示:
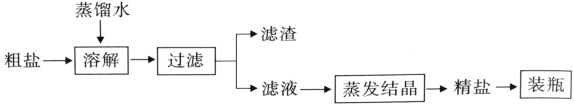
(1)滤液中含量最多的溶质是_______。
(2)玻璃棒在过滤时所起的作用是______。
(3)本实验从滤液得到精盐,采用的是蒸发溶剂而不是降温的方法,结合右图说明其原因是_____。
(4)常温下,10mL蒸馏水最多可溶解NaCl的质量约为_____g(保留1位小数)。
(5)在温度约为_____℃时(取整数),MgSO4饱和溶液的溶质质量分数最大,此时结晶出的NaCl纯度较高。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E、F、G为常见的物质,其中B、E、G属于单质,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系。请回答:
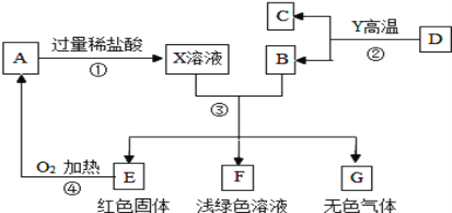
⑴写出物质的化学式:A________;B_________,X溶液中的溶质是__________(填化学式)。
⑵写出反应①的化学方程式:_________,反应④的实验现象_________。
⑶C和D的化学性质不同,其原因是_________。
⑷如图转化中产生无色气体G的原因是________(用化学方程式表示)。
⑸A与G反应的基本类型是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据要求回答下列问题。
用化学用语表示:①2个铵根离子_____;
②氯化钾中的阴离子_____;
③碳酸钠中碳元素的化合价_____;
④地壳中含量居前两位的元素组成的化合物_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】观察下列微粒结构示意图,回答有关问题。
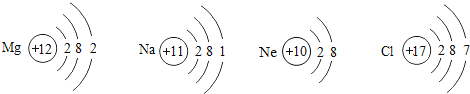
(1)上述粒子中属于金属元素的是_____(填元素符号,下同),在化学反应中易得到电子超向稳定结构的元素是_____
(2)上述粒子中属于单原子分子表示物质的是_____(填元素符号)。
(3)已知氮化钠的化学式为Na3N,则氮元素的化合价为_____;已知硫元素呈现负价时与氧元素相同,则硫化钠的化学式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性学习小组将铁粉投入盛有硫酸铜溶液的试管中,发现生成红色固体物质的同时有较多的气泡放出。这一现象激发起同学们的探究欲望,生成的是什么气体?
(提出猜想)从物质组成元素的角度,放出的气体可能是SO2、O2、H2。
(查阅资料)SO2易溶于水,能与NaOH反应,生成Na2SO3。
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是_____。
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。
(3)实验小组同学合作设计了如图1实验方案,对提出的猜想进行验证。
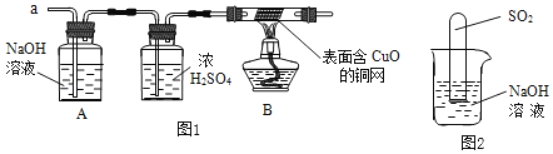
①如果放出的是O2和H2,你认为方案中的安全隐患是_____。
②丙同学认为:为确保安全,实验前应先收集一试管气体,用拇指堵住试管口,_____,若不发出尖锐的爆鸣声,方可采用上面的装置进行实验。
(实验探究)经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量无增减。
(实验结论)铁粉与硫酸铜溶液反应时,产生的气体是_____。
(思维拓展)
(4)由上述实验可以推出,硫酸铜溶液中可能含有_____物质(填酸性、中性或碱性)。
(5)写出装置B中所发生反应的方程式
(6)不通过称量,如何判断SO2与NaOH溶液发生了反应呢?
丁同学设计了如图2所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论。其他同学认为这一方案不严谨,理由是_____。
(定量探究)该研究性学习小组的同学在教师的指导下,设计如下实验方案对硫酸铜溶液进行定量探究。
A.量取100mL上述硫酸铜溶液,倒入放在电子天平上的烧杯中,然后加入20.00g铁粉,充分搅拌,有关实验数据记录如下:
称量项目 | 称量时间 | 质量/g |
烧杯 | 55.65 | |
烧杯+硫酸铜溶液 | 215.65 | |
烧杯+硫酸铜溶液+铁粉 | 30s | 235.59 |
烧杯+硫酸铜溶液+铁粉 | 60s | 235.45 |
烧杯+硫酸铜溶液+铁粉 | 90s | 235.45 |
B.90s后,将烧杯中的物质经“过滤,洗涤、干燥、称量”,得滤渣15.2g。
C.取少量滤渣于试管中,加入稀硫酸,观察到有气泡产生。
(7)请根据实验现象和有关数据,回答下列问题:
①加入铁粉后,用玻璃棒不断搅拌的原因是_____。
②计算上述硫酸铜溶液中CuSO4的质量分数_____。(写出计算过程。)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学为探究煅烧了一段时间的石灰石中剩余固体的成分(杂质不参与反应),进行了以下实验:
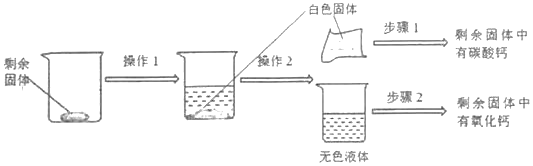
①写出煅烧石灰石反应的化学方程式______;
②操作1为加水溶解,操作2为______;
③步骤1:取白色固体少许,滴加过量的稀盐酸,观察到的现象为______;
④步骤2:取无色液体少许,______;
⑤操作2所得白色固体的成分为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】配制50g6%的氢氧化钠溶液,有关操作如下图所示:
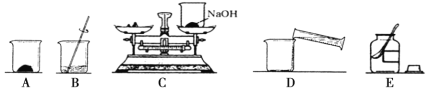
(1)需要氢氧化钠 g,水 mL(水的密度为1g/cm3)
(2)以上实验的正确操作顺序为 (用字母代号表示);C操作中出现的错误是 ;
(3)用pH试纸测定所配制溶液的酸碱度,操作方法为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一定温度下,向图I烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,判断一定正确的是
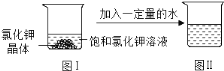
A. 所得溶液是饱和溶液
B. 溶质的质量分数变大
C. 溶质的质量增加
D. 氯化钾的溶解度变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com