
【题目】下列营养物质中能给人体提供能量的是
A. 水 B. 油脂 C. 维生素 D. 无机盐
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:初中化学 来源: 题型:
【题目】I.图-11是实验室制取气体时常用的装置,根据装置回答下列问题:
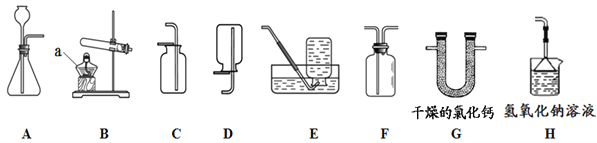
图-11
(1)仪器a的名称是______________;
(2)写出实验室用B装置制取氧气的一个化学方程式___________________________;用E装置收集氧气的适宜时刻是__________________;
(3)收集二氧化碳时,验满的方法是: __________。
(4)硫化氢(H2S)气体是一种有臭鸡蛋气味的有毒气体,易溶于水且水溶液呈酸性。其实验室制取原理是FeS(固)+H2SO4(稀)=FeSO4+H2S↑。要制取该气体,应选择发生装置_________________,并选择装置______________处理尾气防止污染空气。
II.某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
(1)写出该中和反应的化学方程式:____________________________。
(2)探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;
猜想二:可能只有CaCl2;
猜想三:_____________。
【查阅资料】氯化钙溶液呈中性。
【进行实验】
实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象:______________,结论:猜想一不正确
实验步骤:实验步骤取少量烧杯内溶液于另一支试管中,加入适量锌粒
实验现象: _____________ ,结论:猜想二不正确,猜想三正确
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑________________。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?________________(填序号)
A.pH试纸 B.铜 C.氧化铜 D.硝酸银溶液
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是___________(写一条)。要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室用于制取、干燥和收集气体的装置图。

(1)写出指定仪器的名称:①____________②____________
(2)实验室用A制取二氧化碳气体的化学方程式:_________________
现要制取并收集一瓶干燥的二氧化碳气体,请在上述装置中选择合适的装置,按气体的流向用导管的编号将装置连接好:a → _________________。
(3)若用装置B制取氧气,写出该反应的化学方程式:________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图所示进行实验,容器I、II体积相同,装置气密性良好,实验开始前红墨水左右两端液面相平。实验时同时将针筒内溶质质量分数相同且足量的稀硫酸全部迅速注入容器中,实验操作如下表:
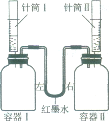
实验编号 | 容器Ⅰ | 针筒Ⅰ | 容器Ⅱ | 针筒Ⅱ |
甲 | 0.01mol镁 | 15mL稀硫酸 | 0.01mol 锌 | 15mL稀硫酸 |
乙 | 0.01mol锌 | 15mL稀硫酸 | 0.01mol铝 | 15mL稀硫酸 |
丙 | 0.01mol铜 | 15mL稀硫酸 | 0.01molg锌 | 15mL稀硫酸 |
实验结束红墨水左右两端液面呈现左高右低。能符合该实验现象的实验编号为
A. 甲、乙 B. 甲、丙
C. 乙、丙 D. 甲、乙、丙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法正确的是
A.过滤时漏斗的末端位于烧杯的中间
B.电解水的过程中,分子和原子的种类都发生改变
C.氢气作为燃料燃烧时对环境污染小
D.氧气加压后变成液氧,是因为分子间的间隔变小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于分子、原子、离子的说法不正确的是
A. 铜、汞等金属单质都是由原子构成的物质
B. 氯化钠、硫酸铜均是由阴、阳离子构成的物质
C. 氧气、金刚石等非金属单质都是由分子构成的物质
D. 水、氨气的化学性质分别是由水分子和氨分子保持的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某腐蚀印刷电路板的废液中含有CuCl2和FeCl2,为了分析该废液的组成,取1 000 g废液,设计如下实验方案进行探究:
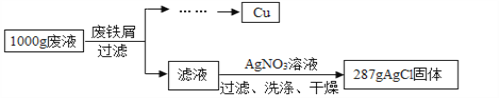
实验过程中加入废铁屑的质量、析出Cu的质量的数据记录如下表:
废铁屑的质量/g | 20 | 40 | 60 | 80 |
析出Cu的质量/g | 12.8 | 25.6 | 32 | 32 |
(注:废铁屑中的杂质不溶于废液也不与废液反应,不考虑过滤中的损失。)
(1)1 000 g废液与足量废铁屑完全反应,析出Cu的质量为_______ g。
(2)废铁屑中单质Fe的质量分数为_______________。
(3)计算1 000 g废液中CuCl2的质量分数_______。(写出计算过程,结果保留小数点后一位)
(4)1 000 g废液中FeCl2的质量分数为_________。(结果保留小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com