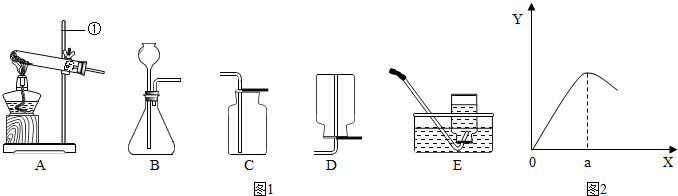
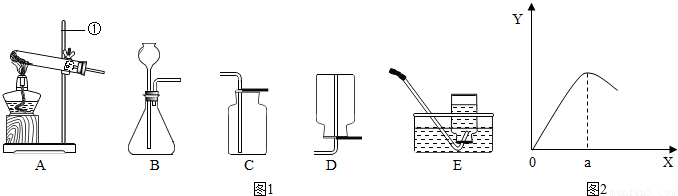
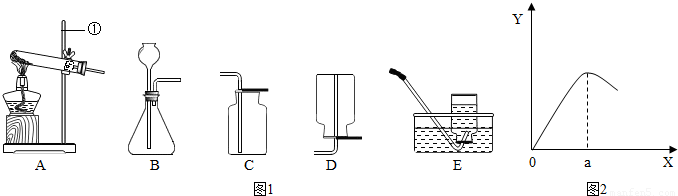
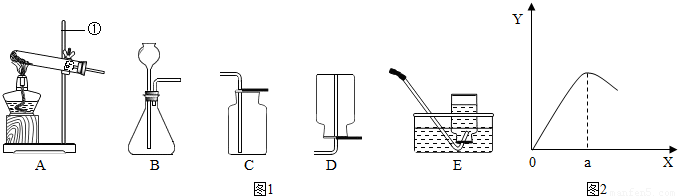
解:(1)①是铁架台;
(2)检查B装置的气密性的方法是:用弹簧夹夹住右侧导气管,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室制取氢气的药品是锌和稀硫酸,反应产生硫酸锌和氢气,反应的方程式为:Zn+H
2SO
4═ZnSO
4+H
2↑;该反应是固体和液体在常温下反应,所以发生装置为:B;
(4)设需要浓硫酸的体积为V,则
根据浓溶液在配制稀溶液时溶质的质量不变得,
V×1.84g/cm
3×98%=30mL×1.30g/cm
3×40%
解得V=8.7mL,
水的质量为30mL×1.30g/cm
3-8.7mL×1.84g/cm
3=23.0g,
则水的体积:
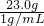
=23.0ml
量取浓硫酸时,若仰视读数会使量取的体积偏大,则会使溶质偏多,则所配硫酸的质量分数>40%;配制的步骤为:计算、量取(量筒、胶头滴管)、溶解(烧杯、玻璃棒),故不需要的是托盘天平和铁架台;
(5)①实验室制取氢气的药品是锌和稀硫酸,因为锌的活动性排在铜的前面,故滴入CuSO
4溶液后,发生反应的化学方程式为:Zn+CuSO
4═ZnSO
4+Cu;
②根据坐标看出:a点过后,反应速率降低,其原因可能是:生成的Cu覆盖在Zn表面,阻止反应进一步进行(或硫酸浓度变小,使反应速率降低);
故答案为:(1)铁架台;(2)用弹簧夹夹住右侧导气管;(3)Zn+H
2SO
4═ZnSO
4+H
2↑;B;(4)8.7 23.0(或23.1);>;AF;(5)①Zn+CuSO
4═ZnSO
4+Cu ②生成的Cu覆盖在Zn表面,阻止反应进一步进行(或硫酸浓度变小,使反应速率降低)
分析:(1)熟练掌握常见化学仪器的名称及其用途;
(2)检查B装置的气密性的方法是:用弹簧夹夹住右侧导气管,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室制取氢气的药品是锌和稀硫酸,反应产生硫酸锌和氢气;根据反应物的状态和反应条件选择发生装置;
(4)利用m=ρV可计算溶液的质量,再根据溶液配制前后溶质的质量不变来列式计算,根据稀溶液与浓溶液的质量差来计算水的质量,进一步得到需加水的体积;根据量筒的使用方法分析误差及实验需要的仪器;
(5)根据金属和盐溶液的反应书写方程式并根据坐标分析原因.
点评:本题考查了氢气的制取及需要的稀硫酸的配制、金属和盐溶液的反应等,综合性较强,关键是熟练相关的知识结合题中相关的信息分析回答.

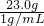 =23.0ml
=23.0ml

 一线名师提优试卷系列答案
一线名师提优试卷系列答案