
 某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打.参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中小苏打的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.4g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(计算结果保留到小数点后一位数字)
某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打.参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中小苏打的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.4g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(计算结果保留到小数点后一位数字)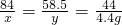
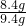 ×100%≈89.4%
×100%≈89.4%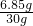 ×100%=22.8%
×100%=22.8%

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:初中化学 来源: 题型:
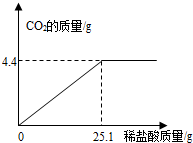 某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠).参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.3g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打(碳酸氢钠).参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中碳酸氢钠的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.3g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)查看答案和解析>>
科目:初中化学 来源: 题型:
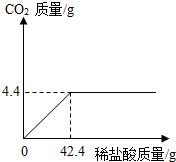 某班一次社会实践活动是到碱厂参观,该厂主要产品之一是纯碱.参观结束,同学们带回一些化验室里废弃的纯碱样品,来测定其中碳酸钠的质量分数(假设该样品中只含有氯化钠一种杂质).取样品12g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)
某班一次社会实践活动是到碱厂参观,该厂主要产品之一是纯碱.参观结束,同学们带回一些化验室里废弃的纯碱样品,来测定其中碳酸钠的质量分数(假设该样品中只含有氯化钠一种杂质).取样品12g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如右图所示,求:(计算结果用百分数表示,保留到小数点后一位数字)查看答案和解析>>
科目:初中化学 来源: 题型:
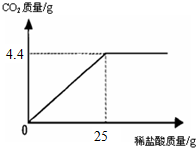 某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打.参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中小苏打的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.4g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(计算结果保留到小数点后一位数字)
某班一次社会实践活动是到连云港碱厂参观,该厂主要产品之一是小苏打.参观结束,同学们带回一些化验室里废弃的小苏打样品,来测定其中小苏打的质量分数(假设该样品中只含有氯化钠一种杂质).取样品9.4g逐滴加入稀盐酸,生成CO2气体的质量与滴加稀盐酸的质量关系如图所示,NaHCO3+HCl═NaCl+H2O+CO2↑求:(计算结果保留到小数点后一位数字)查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com