
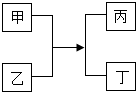
 甲乙丙丁是初中化学中的常见物质,它们是由H、O、Cl、Fe、Na五种元素中的一种或几种组成,其转化关系如图所示,请根据要求用化学式填空:
甲乙丙丁是初中化学中的常见物质,它们是由H、O、Cl、Fe、Na五种元素中的一种或几种组成,其转化关系如图所示,请根据要求用化学式填空:分析 (1)由提供的元素,根据金属能与酸发生置换反应,氢气具有还原性,能与金属氧化物反应,进行分析解答.
(2)如丙和丁分别是氢氧化铁和氯化钠,根据复分解反应发生的条件,氢氧化铁和氯化钠反应物交换成分生成的,则反应物是氯化铁与氢氧化钠溶液,据此进行分析解答.
解答 解:(1)由提供的元素,如甲是金属单质,则乙可能为稀盐酸,铁与稀盐酸反应生成氯化亚铁和氢气,稀盐酸的化学式为HCl.
如甲为非金属单质,氢气具有还原性,能与金属氧化物反应,氢气与氧化铁在高温条件下生成铁和水,则乙可能为氧化铁,其化学式为:Fe2O3.
(2)如丙和丁分别是氢氧化铁和氯化钠,根据复分解反应发生的条件,氢氧化铁和氯化钠反应物交换成分生成的,则反应物是氯化铁与氢氧化钠溶液,甲为含氯化合物,甲是氯化铁溶液,乙是氢氧化钠溶液,其化学式分别是FeCl3、NaOH.
故答案为:(1)HCl;Fe2O3;(2)FeCl3;NaOH.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
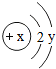 ,则Y=8.
,则Y=8.
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H+ K+ CO32- | B. | Mg2+ Cl- OH- | ||
| C. | Cu2+ SO42- H+ | D. | Ba2+ Na+ SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 “寒假假期”,小兵对“铁与稀硫酸反应快慢的影响因素”进行了探究.
“寒假假期”,小兵对“铁与稀硫酸反应快慢的影响因素”进行了探究.| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
| 实验 编号 | 试剂 | 前10min内产生的 氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL30% | 564.3 |
| b | 含杂质的锌 | 30mL30% | 634.7 |
| c | 纯锌 | 40mL30% | 449.3 |
| d | 纯锌 | 40mL30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
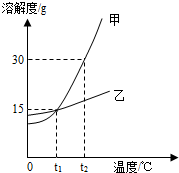 如图是甲、乙两物质的溶解度曲线,下列说法正确的是( )
如图是甲、乙两物质的溶解度曲线,下列说法正确的是( )| A. | 甲的溶解度大于乙的溶解度 | |
| B. | t1℃时甲、乙两物质的饱和溶液中的溶质的质量分数均各15% | |
| C. | 将接近饱和的甲溶液升高温度可变为饱和溶液 | |
| D. | t2℃时,将相同质量的甲、乙两种物质分别配成饱和溶液,得到的溶液质量乙>甲 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH、CuS04、H2SO4 | B. | NaCl、Na2S04、NaOH | ||
| C. | NaCl、Ba(N03)2、HC1 | D. | NH4N03、NaOH、Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com