
| A. | CO2、H2SO4、NaOH、NaCl | B. | KClO3、H2CO3、Ca(OH)2、Na2CO3 | ||
| C. | H2O、H2O2、NH3•H2O、KMnO4 | D. | O2、NaHSO4、C2H5OH、CaCO3 |
分析 根据氧化物、酸、碱、盐、混合物的特点分析即可:氧化物是由两种元素组成并且一种元素是氧元素的化合物;电离时生成的阳离子都是氢离子的化合物是酸;电离时生成的阴离子都是氢氧根离子的化合物是碱;由金属离子和酸根离子组成的化合物是盐;混合物是由多种物质组成的物质.据此逐项分析判断即可.
解答 解:A、CO2 属于氧化物,H2SO4属于酸,NaOH属于碱,NaCl属于盐,故选项正确;
B、KClO3属于盐,H2CO3属于酸,Ca(OH)2属于碱,Na2CO3属于酸,故选项错误;
C、H2O属于氧化物,H2O2 属于氧化物,NH3•H2O属于碱,KMnO4属于盐.故选项错误;
D、O2属于单质,NaHSO4属于盐,C2H5OH属于有机物,不属于碱,CaCO3属于盐,故选项错误.
故选A.
点评 本题主要考查物质分类的知识,解答时要分析物质的元素组成,然后再根据酸碱盐概念、特征进行分析、判断;解题时可用排除法排除不符合题意的选项.


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:初中化学 来源: 题型:填空题
| 实验序号 | 实验1 | 实验2 | 实验3 | 实验4 |
| 水的质量(g) | 100 | 100 | 100 | 100 |
| 加入硝酸钾的质量(g) | 80 | 100 | 120 | 140 |
| 溶液的质量(g) | 180 | 200 | 210 | 210 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
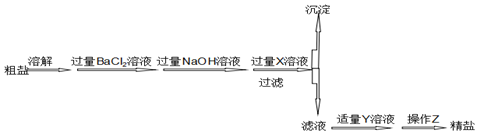
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 溶液中Ca2+总数不变 | B. | 溶质的质量分数不变 | ||
| C. | 单位体积内的OH-数目不变 | D. | 溶液的质量不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Na2CO3、CaCl2 | B. | K2CO3、Na2CO3 | C. | NaHCO3、MgCO3 | D. | NaHCO3、K2CO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| A. | 硝酸钾和氯化钠的溶解度曲线在20℃~30℃温度范围内相交 | |
| B. | 在60℃时,硝酸钾的饱和溶液105g加入95g水后,溶液中溶质的质量分数为27.5% | |
| C. | 在20℃时,氯化钠和硝酸钾固体各35g分别加入两只各盛有100g水的烧杯中,均不能形成饱和溶液 | |
| D. | 从含有少量氯化钠的硝酸钾饱和溶液中得到较多的硝酸钾晶体,通常可采用冷却热饱和溶液的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | $\frac{32a}{b-a}$ | B. | $\frac{16a}{b-a}$ | C. | $\frac{32b}{b-a}$ | D. | $\frac{12(b-a)}{a}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
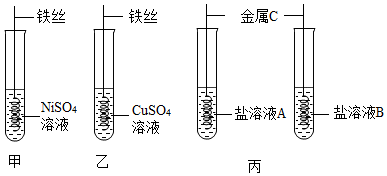
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com