
 金属是生产、生活中应用广泛的材料.
金属是生产、生活中应用广泛的材料.
分析 (1)根据铁会与酸反应生成进行分析;
(2)根据活泼性强的金属首先被腐蚀的变化规律,为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌的金属活动性应比铁的活动性强;
(3)①根据防锈就是使铁与水或氧气隔绝进行分析;
②根据质量守恒定律进行分析;
③根据铁能与硫酸铜反应生成硫酸亚铁和铜,可观察到铁丝表面出现红色固体,溶液由蓝色逐渐变为无色进行分析;
(4)①根据一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳进行分析;
②根据一氧化碳和氧化铜反应的注意事项以及物质质量的关系进行解答即可;
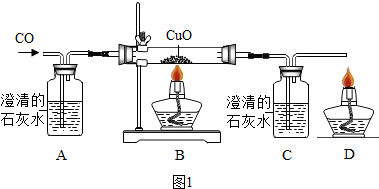
③根据装置A的作用进行分析;
(5)Ⅰ根据制取气体是先要检查装置的气密性进行分析;
Ⅱ要使装置随开随用,随关随停,那就要控制可以两种药品接触与分离;
Ⅲ水可以吸收盐酸挥发的氯化氢气体,同时与长玻璃管起到缓冲压力的作用,浓硫酸具有吸水性;
Ⅳ根据CuO样品的质量,E中增重水的质量分析铜的相对原子质量;F装置阻止空气中的水蒸气浸入E装置,结合方程式只要能包含铜或氧化铜的质量数据,列比例式就可求解;
Ⅴ根据实验中无法判断CuO是否完全反应.
解答 解:(1)铁的活动性在H的前面,能与酸反应,所以酸菜等酸性的食物不宜用铁质器具长期盛放;
(2)根据金属活动性顺序,五种金属的活动性强弱关系为锌>铁>铅>铜>铂,根据分析,为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌的金属是锌板,故选:D;
(3)①经“发蓝”处理后的钢铁零件表面上的蓝黑色氧化膜能够使铁与水或氧气隔绝,从而避免(减缓)钢铁腐蚀;
②根据质量守恒定律,反应前后原子的种类和数目不变,反应前:Fe原子数目为36,Na原子的数目为13,N原子的数目为13,O原子的数目为57,H原子的数目为52;反应后:Fe原子数目为0,Na原子的数目为13,N原子的数目为13,O原子的数目为13,H原子的数目为52;所以X的化学式为Fe3O4;
③如果氧化膜不致密,裸露出来的铁与硫酸铜的反应生成了铜和硫酸亚铁,反应的方程式为Fe+CuSO4 ═FeSO4 +Cu,所以将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质.由此可知该零件“发蓝”处理效果不好;
(4)①一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,化学方程式为:CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,该反应的还原剂是CO;
②A中的液体是排除二氧化碳气体;CO通入灼热的氧化铜,将其黑色氧化铜还原为红色的铜单质,并有二氧化碳气体生成,其反应方程式为:CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2;因为CO具有毒性,所以在D处将多余的CO点燃,防止污染空气;
A、实验结束时应先熄灭B处酒精灯,故A正确;
B、C中增加的质量是二氧化碳的质量,B中固体减小的质量是氧元素的质量,故质量不相等,故B错误;
C、该反应前后都要通入一氧化碳,所以反应开始后通入2.8g一氧化碳可生成6.4g铜,故C错误;
D、反应结束后继续通入一氧化碳的目的是防止铜被氧化,故D正确;
故选:AD;
③甲同学认为A装置用于证明一氧化碳不能和石灰水反应,乙同学认为省略A可达到同样的目的,理由是:为了排尽装置中的空气,反应前已经通入一段时间的一氧化碳;
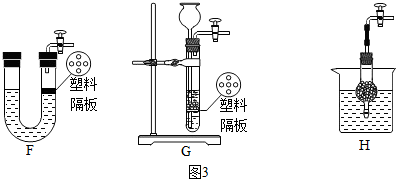
(5)Ⅰ、制取气体是先要检查装置的气密性;
ⅡF、装置当液体与固体接触时反应,由于另一端橡皮塞,关闭活塞不能使液体进入另一端使两种药品分离,所以不可选;
G、装置当液体与固体接触时反应,关闭活塞后液体在压力作用下进入长颈漏斗,使两种药品分离,反应停止,所以可选;
H、装置当把干燥管浸入液体,液体与固体接触时反应,把干燥管从液体中拿出,使两种药品分离,反应停止,所以可选;
故选:GH;
ⅢB是安全瓶,B中气体压力过大时,水就会从玻璃管上端溢出,D中所盛是水,水的作用吸收盐酸挥发的氯化氢气体,浓硫酸具有吸水性,干燥氢气;
Ⅳ设铜的相对原子质量为x
H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O.
x+16 18
m1 m2
$\frac{x+16}{{m}_{1}}$=$\frac{18}{{m}_{2}}$
x=$\frac{18{m}_{1}}{m2}$-16;
F装置阻止空气中的水蒸气浸入E装置,若无F装置,E中增重m2变大,则对测定结果偏小;结合方程式只要能包含铜或氧化铜的质量数据,列比例式就可求解,故选ABC;
Ⅴ实验中无法判断CuO是否完全反应,从而无法进行相应的计算.
故答案为:(1)铁会与酸反应而使铁质器具被腐蚀;
(2)D;
(3)①致密的氧化膜使铁与氧气(或空气)和水隔绝;
②Fe3O4;
③不好;
(4)①CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,CO;
②AD;
③为了排尽装置中的空气,反应前已经通入一段时间的一氧化碳;
(5)Ⅰ.检查装置的气密性;
Ⅱ.GH;
Ⅲ.起安全作用,当B中气体压力过大时,水就会从玻璃管上端溢出;干燥氢气;
Ⅳ.$\frac{18{m}_{1}}{{m}_{2}}$-16,偏小,ABC;
Ⅴ.实验中无法判断CuO是否完全反应,从而无法进行相应的计算.
点评 本题考查了实验室制氢气的原理以及根据反应的原理选择合适的实验装置,学生的平常的化学学习中一定要注重对双基知识的学习,只有具备完整的知识系统,才能够很好的解决综合问题.


 小学教材全测系列答案
小学教材全测系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题


查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 有一研究性学习小组为测定某铜锌合金的成分,取l0g该合金经粉碎后放入烧杯中,再加入93.7g质量分数为20%的稀硫酸(反应后硫酸有剩余),反应过程中烧杯内固体物质的质量与反应时间的关系如图所示.请回答下列问题:
有一研究性学习小组为测定某铜锌合金的成分,取l0g该合金经粉碎后放入烧杯中,再加入93.7g质量分数为20%的稀硫酸(反应后硫酸有剩余),反应过程中烧杯内固体物质的质量与反应时间的关系如图所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com