
 2CaSO4+______.
2CaSO4+______.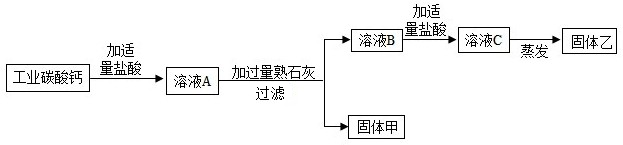


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:阅读理解
| 选项 | A | B | C | D |
| 物质 | 橘子 | 泡菜 | 葡萄 | 玉米粥 |
| pH | 2.9~3.5 | 3.0~4.0 | 3.5~4.5 | 6.8-8.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2010?三明)2010年全国“两会”代表和委员们首次使用环保“石头纸”制作的便笺和文件袋.“石头纸”是一种低碳经济的绿色产品,它的主要成分是一种含钙的盐类化合物.某学习小组对“石头纸”进行如下图所示实验,观察到澄清石灰水变浑浊.
(2010?三明)2010年全国“两会”代表和委员们首次使用环保“石头纸”制作的便笺和文件袋.“石头纸”是一种低碳经济的绿色产品,它的主要成分是一种含钙的盐类化合物.某学习小组对“石头纸”进行如下图所示实验,观察到澄清石灰水变浑浊.查看答案和解析>>
科目:初中化学 来源: 题型:
| ||

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
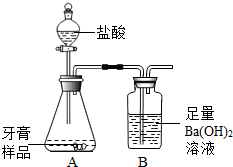 (2013?高邮市二模)化学兴趣小组对某品牌牙膏中碳酸钙含量进行以下探究.该牙膏摩擦剂主要由碳酸钙、氢氧化铝组成,其他成分遇到盐酸时无气体生成.现利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.请回答下列问题.
(2013?高邮市二模)化学兴趣小组对某品牌牙膏中碳酸钙含量进行以下探究.该牙膏摩擦剂主要由碳酸钙、氢氧化铝组成,其他成分遇到盐酸时无气体生成.现利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数.请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com