12.催化剂在科研、医药生产和电子工业等前沿领域有着广泛应用.

【实验1】验证二氧化锰是过氧化氢分解反应的催化剂
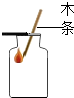
某同学设计如下实验:分别取5mL5%的过氧化氢溶液于两支试管中,向B中试管内加入少量二氧化锰(如图1所示).A中带火星的木条不复燃,B中带火星的木条复燃.
A中木条不复燃的原因是氧气的浓度不够或没有氧气产生,B中反应的化学方程式是2H
2O
2$\frac{\underline{\;MnO_2\;}}{\;}$2H
2O+O
2↑.
有同学认为上述实验方案不足以证明二氧化锰是该反应的催化剂,理由是不能证明二氧化锰在反应前后的质量和化学性质没有改变.
【实验2】为探究二氧化锰对氯酸钾分解的催化作用.在相同条件下,同学们按下表进行实验,并记录相关数据.(其他影响实验的因素均相同)
| 编号 | KC103 质量/g | 其他物质质量/g | 待测数据 |
| 实验1 | 2.0 | / | |
| 实验2 | a | Mn02 0.5 | |
①表中a的数值应是2.0;
②表中的待测数据指D(填字母序号).
A.氧气的质量 B.反应后固体的质量
C.氧气的体积 D.单位时间内产生氧气的体积
③设计“实验1”的目的是对比.
【拓展】
(1)同学们继续探究二氧化锰是否参与了氯酸钾的分解反应.
氯酸钾和二氧化锰混合加热的化学方程式为:2KClO
3$\frac{\underline{MnO_2}}{△}$2KC1+30
2↑.已知氯酸钾与二氧化锰混合加热时连续发生如下反应,试分析后按要求填空.
(I)2KC10
3+2Mn0
2$\frac{\underline{\;\;△\;\;}}{\;}$2KMn0
4+Cl
2↑+0
2↑;
(Ⅱ)2KMnO
4$\frac{\underline{\;\;△\;\;}}{\;}$K
2MnO
4+MnO
2+O
2↑(用化学方程式表示);
(Ⅲ)K
2Mn0
4+Cl
2$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+Mn0
2+0
2↑.
通过以上分析,同学们得出结论:二氧化锰参与了氯酸钾的分解反应.
(2)氟利昂释放出的氯原子参与了臭氧层的破坏,其他微观示意图如图2,综合图中①②③的反应过程,写出臭氧层被破坏的化学方程式:2O
3$\frac{\underline{\;\;\;CL\;\;\;}}{日光}$3O
2.


 倾倒药品
倾倒药品