
| 你的假设 | 实验步骤 | 实验现象 | 实验结论 |
| 滤液中溶质可能是_______ | 猜想成立 |
| 你的假设 | 实验步骤 | 实验现象 |
| NaCl、NaOH、Ca(OH)2 | 取少量的滤液于试管中,通入二氧化碳气体(或加入碳酸钠溶液) | 有白色沉淀出现 |


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
| 验内容 | 验证方法 | 思路 |
| 验证推测一 | 向蒸馏水中,滴加紫色石蕊试液,观察现象.石蕊试液不变色 |
说明水分子不能使紫色石蕊试液变色 |
| 验证推测二 | 向硫酸钠钠溶液中,滴加紫色石蕊试液,观察现象.石蕊试液不变色 |
说明硫酸根离子不能使紫色石蕊试液变色 |
| 验证推测三 | 向稀硫酸中,滴加紫色石蕊试液,观察现象.石蕊试液变红色 |
说明氢离子能使紫色石蕊试液变红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
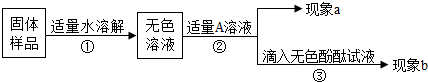
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
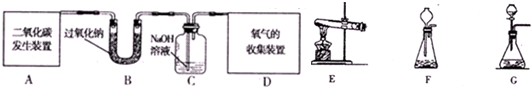
| 实验步骤 | 实验现象 | 实验结论 |
| 将二氧化碳与过氧化钠反应后的固体 加入一只小试管中,然后滴加适量的稀盐酸,再把生成的气体通入澄清的石灰水 加入一只小试管中,然后滴加适量的稀盐酸,再把生成的气体通入澄清的石灰水 |
试管中有气泡冒出,澄清的石灰水变浑浊 试管中有气泡冒出,澄清的石灰水变浑浊 |
二氧化碳与过氧化钠反应生成的化合物是 碳酸盐 碳酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com