

| 加热时间(min) | 0 | t1 | t2 | t3 |
| 玻璃管及其中固体质量(g) | 56.66 | 55.20 | 54.80 | 54.80 |
分析 (1)根据质量守恒定律进行分析配平后的系数;
(2)根据题中的反应原理和装置C的作用进行分析,根据烧碱有吸水性和潮解后会与空气中的二氧化碳反应进行分析;
(3)根据表中固体质量的变化情况进行分析;
(4)根据碱式碳酸铜分解的方程式,由减少的质量是二氧化碳和水的质量计算碱式碳酸铜的质量,
(5)根据试管内温度、压强的变化分析回答现象.
(6)根据表中数据的变化,不能判断碱式碳酸铜是否完全分解,对后面的判断也会产生影响等进行分析.
解答 解:(1)依据质量守恒定律可知,化学反应前后原子个数不变,然后依据配平化学方程式的方法可知,Cu2(OH)2CO3═2CuO+H2O+CO2↑,所以在□中填入配平后的系数,依次为1、2、1、1,
(2)该反应是实验室利用碱式碳酸铜(化学式:Cu2(OH)2CO3)制备氧化铜,并检验产物,检验水常用无水硫酸铜,检验二氧化碳常用澄清石灰水,需要先检验水,再检验二氧化碳,所以C中试剂是无水硫酸铜,空气中的二氧化碳和水蒸气会对二氧化碳、水蒸气的检验造成干扰,所以A烧碱固体的作用是吸收空气中的二氧化碳和水蒸气;
(3)固体质量不再变化时,可以认为碱式碳酸铜完全分解,t2,t3时固体质量不再改变,所以选择t3时停止加热的理由是:固体质量不再减少,证明碱式碳酸铜已经完全分解;
(4)设原碱式碳酸铜的质量为x,生成二氧化碳和水的质量为:56.66g-54.80g=1.86g
Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑
221 62
x 1.86g
$\frac{221}{62}=\frac{x}{1.86g}$ 解得:x=6.63g
(5)若仅撤走酒精喷灯停止加热,可能导致的后果是:F中的液体通过导管流入E中,造成试管炸裂;
(6)通过步骤③中的数据比较,可以判断碱式碳酸铜是否分解完全,如果没有分解完全,在后面的加热过程中,碱式碳酸铜会生成二氧化碳,对氧化铜和木炭的还原产物的检验造成干扰,所以若①中省略步骤三,对②中反应产物判断可能产生的影响及其原因:不能确定炭粉还原氧化铜的生成物中是否含有二氧化碳.
因为可能有①中未分解的碱式碳酸铜在实验②中分解,产生二氧化碳气体,干扰对炭粉还原氧化铜反应生成物的判断.
故答案为:(1)1、2、1、1;(2)吸收空气中的二氧化碳和水蒸气;(3)固体质量不再减少,证明碱式碳酸铜已经完全分解;(4)6.63g;(5)F中的液体通过导管流入E中,造成试管炸裂;(6)③不能确定炭粉还原氧化铜的生成物中是否含有二氧化碳.因为可能有①中未分解的碱式碳酸铜在实验②中分解,产生二氧化碳气体,干扰对炭粉还原氧化铜反应生成物的判断.
点评 在解此类题时,首先分析题中各个步骤和反应的作用,然后结合学过的知识和题中所给的条件进行分析解答.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
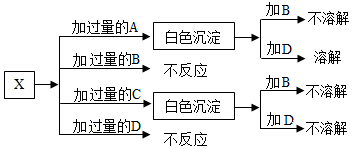 A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种物质的溶液,现利用一种可溶性镁盐X做如图所示的实验,就可将它们一一鉴别出来:
A、B、C、D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种物质的溶液,现利用一种可溶性镁盐X做如图所示的实验,就可将它们一一鉴别出来:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com