
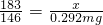
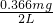 =0.183mg/L
=0.183mg/L

 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:
 2012年1月15日,广西龙江河发生镉污染事件,一度造成柳江上游非饮用水保护河段轻微污染.为防止水源进一步被污染,当地政府迅速组织人员向江水里投放熟石灰提高受污染水中的pH值,使水呈弱碱性,此时镉离子将以碳酸镉,氢氧化镉细小颗粒沉淀,同时投放聚合氯化铝将这些细小颗粒凝聚.经过近半个月的处理,镉污染处置已见成效.
2012年1月15日,广西龙江河发生镉污染事件,一度造成柳江上游非饮用水保护河段轻微污染.为防止水源进一步被污染,当地政府迅速组织人员向江水里投放熟石灰提高受污染水中的pH值,使水呈弱碱性,此时镉离子将以碳酸镉,氢氧化镉细小颗粒沉淀,同时投放聚合氯化铝将这些细小颗粒凝聚.经过近半个月的处理,镉污染处置已见成效.查看答案和解析>>
科目:初中化学 来源: 题型:
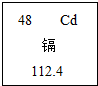
 广西龙江河2012年1月15日出现重金属镉含量超标,26日污染水体进入下游柳江系统,27日柳江上游河段镉浓度超标达5倍.当环境受到镉污染后,镉可在生物体内富集,通过食物链进入人体引起慢性中毒.如图是元素周期表中镉元素的相关信息,下列说法正确的是( )
广西龙江河2012年1月15日出现重金属镉含量超标,26日污染水体进入下游柳江系统,27日柳江上游河段镉浓度超标达5倍.当环境受到镉污染后,镉可在生物体内富集,通过食物链进入人体引起慢性中毒.如图是元素周期表中镉元素的相关信息,下列说法正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com