【答案】
分析:㈠(1)根据仪器的形状、结构、用途回答.
(2)根据药品的状态、反应条件和气体的性质确定装置;根据实验室用加热高锰酸钾制氧气的原理书写方程式.
(3)根据高锰酸钾加热易变为纤细粉末的特点判断.
(4)根据过滤的原理回答.
(二)(1)根据药品的状态、反应条件回答.
(2)根据硫化氢的密度判断.
(3)根据硫化氢的溶解性和其溶液的酸性回答.
(4)根据配制一定质量分数的稀硫酸的操作过程和使用的仪器回答.
(5)根据溶液稀释溶质质量不变的原理计算.
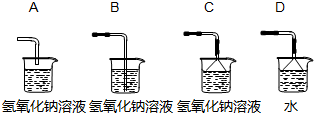
解答:解:㈠(1)①是少量试剂的反应容器,叫试管;②是加入液体药品的仪器,没有盖和活塞,是长径漏斗.
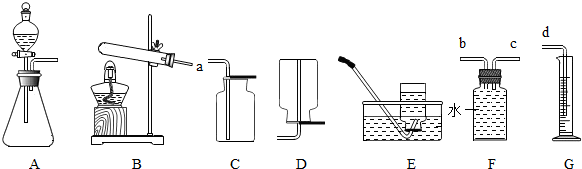
(2)实验室用加热高锰酸钾制氧气是加热固体制气体,气体发生装置选择A;高锰酸钾加热生成锰酸钾、二氧化锰、氧气,故方程式为:2KMnO
4
K
2MnO
4+MnO
2+O
2↑.
(3)高锰酸钾加热易变为纤细粉末,会随气流进入并堵塞导管.
(4)二氧化锰不溶解于水,高锰酸钾和锰酸钾易溶于水,加水溶解后可用过滤的方法提取二氧化锰.
(二)(1)用硫化亚铁固体和稀硫酸混合来制取硫化氢,药品分别是固体和液体,反应不需要加热,气体发生装置用B.
(2)如图装置为排空气法,硫化氢的密度比空气大,应用向上排空气法,故气体应从A端通入.
(3)硫化氢气体能溶解于水,试管中气压会减小,故试管内液面上升;其水溶液呈酸性,能使石蕊试液变红色.
(4)配制一定质量分数的稀硫酸用到的仪器有:量筒、滴管、烧杯、玻璃棒,药匙是取用固体药品的,该实验不用,酒精灯中加热仪器,该实验不需要加热,故也不用.
(5)解:溶液中溶质硫酸质量为200mL×1.14g/mL×20%=45.6g
浓硫酸质量为45.6g÷98%=46.5g
浓硫酸体积为46.5g÷1.84g/mL=25.3mL
需水体积为(200mL×1.14g/mL-46.5g)÷1g/mL=181.5mL
答:需98%的浓硫酸25.3mL,水181.5mL.
故答案为:㈠(1)①试管;②长颈漏斗;(2)AC(或AE);2KMnO
4
K
2MnO
4+MnO
2+O
2↑;(3)试管口堵一团棉花;(4)过滤;(二)(1)B;(2)A;(3)试管内液面上升;红;(4)AB;
(5)解:溶液中溶质硫酸质量为200mL×1.14g/mL×20%=45.6g
浓硫酸质量为45.6g÷98%=46.5g
浓硫酸体积为46.5g÷1.84g/mL=25.3mL
需水体积为(200mL×1.14g/mL-46.5g)÷1g/mL=181.5mL
答:需98%的浓硫酸25.3mL,水181.5mL.
点评:气体的制取是初中重要的化学实验之一,既是难重点,又是考查热点,理解反应原理,掌握装置的选择依据、气体的检验、验满、收集方法,了解实验步骤和注意事项是解决该类问题的关键.


 K2MnO4+MnO2+O2↑.
K2MnO4+MnO2+O2↑. K2MnO4+MnO2+O2↑;(3)试管口堵一团棉花;(4)过滤;(二)(1)B;(2)A;(3)试管内液面上升;红;(4)AB;
K2MnO4+MnO2+O2↑;(3)试管口堵一团棉花;(4)过滤;(二)(1)B;(2)A;(3)试管内液面上升;红;(4)AB;

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案