
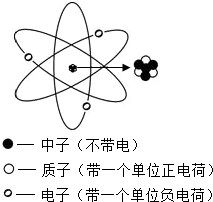
 原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中.其中,行星模型的提出标志着原子结构的现代模型的问世,如图是锂原子结构的行星模型,图中原子核内有3个质子、4个中子.不能根据原子结构的行星模型得出的结论是( )
原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中.其中,行星模型的提出标志着原子结构的现代模型的问世,如图是锂原子结构的行星模型,图中原子核内有3个质子、4个中子.不能根据原子结构的行星模型得出的结论是( )| A. | 原子始终在做无规则的运动 | |
| B. | 原子核的体积只占整个原子体积的很小部分 | |
| C. | 构成原子核的粒子之间存在一种互相吸引的力 | |
| D. | 原子呈电中性 |
科目:初中化学 来源: 题型:实验探究题
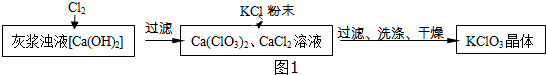
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
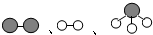 分别表示N2、H2、NH3.观察如图,写出符合在催化剂表面合成氨反应过程的顺序⑤④①②③(将如图五张图按反应过程顺序用序号排列).
分别表示N2、H2、NH3.观察如图,写出符合在催化剂表面合成氨反应过程的顺序⑤④①②③(将如图五张图按反应过程顺序用序号排列).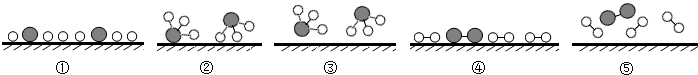
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
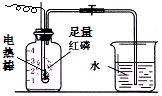 按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:
按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 加热时间(min) | 0 | t1 | t2 | t3 |
| B中固体质量(g) | 6.66 | 5.20 | 4.80 | 4.80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com