
分析 (1)碱溶液中都含有自由移动的氢氧根离子;
(2)利用pH试纸可以测定溶液的酸碱度;
测定pH时,若pH试纸用蒸馏水湿润,则测出的pH不准确,如果是酸性溶液,测定结果偏大,如果的碱性溶液,测定结果偏小.
解答 解:(1)碱之所以具有相似化学性质,是因为碱溶于水时,都能够电离出自由移动的氢氧根离子,氢氧根离子可以表示为OH-;
(2)检验土壤的酸碱度时,可以取少量土壤样品与蒸馏水混合,充分搅拌后静置,把pH试纸放在玻璃片上,用玻璃棒蘸上层清液滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,可以测出土壤pH,由于土壤的浸出液显酸性,若pH试纸用蒸馏水湿润时,会导致酸性减弱,从而导致测出的pH偏大.
故填:OH-; 蒸馏水; 玻璃棒;标准比色卡;偏大.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


科目:初中化学 来源:安徽省巢湖市心学校2017届九年级中考强化训练化学试卷 题型:选择题
下列图象正确反映对应的变化关系的是( )
A. 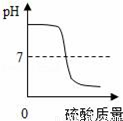 向一定量的氢氧化钠溶液中滴加稀硫酸至过量
向一定量的氢氧化钠溶液中滴加稀硫酸至过量
B. 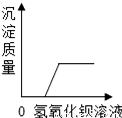 向一定量的硫酸和硫酸镁混合溶液中滴加氢氧化钡溶液
向一定量的硫酸和硫酸镁混合溶液中滴加氢氧化钡溶液
C. 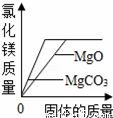 将足量碳酸镁和氧化镁固体分别加入相同质量、相同质量分数的稀盐酸中
将足量碳酸镁和氧化镁固体分别加入相同质量、相同质量分数的稀盐酸中
D. 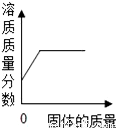 在一定温度下,向不饱和的硝酸钠溶液中不断加入硝酸钠固体,充分搅拌
在一定温度下,向不饱和的硝酸钠溶液中不断加入硝酸钠固体,充分搅拌
查看答案和解析>>
科目:初中化学 来源:2017届广东省汕头市龙湖区九年级5月模拟考试化学试卷(解析版) 题型:选择题
水是生命之源,下列有关水的说法不正确的是( )
A.水的电解实验说明水是由氢气和氧气组成的
B.生活中通过煮沸的方法可以降低水的硬度
C.用蒸馏的方法可以将海水淡化
D.爱护水资源主要从节约用水和防治水体污染两方面采取相应措施
查看答案和解析>>
科目:初中化学 来源:2017届山东省日照市莒县九年级下学期第二次学业水平模拟测试化学试卷(解析版) 题型:选择填充题
物质的宏观性质与微观组成(或结构)相互联系是化学特有的思维方式, 下列对物质性质的微观解释不正确的是( )
A. 降温能使水结冰,是因为在较低的温度下水分子静止不动
B. 水和过氧化氢化学性质不同,是因为分子的构成不同
C. 稀有气体的化学性质比较稳定,是因为它们的原子结构都相对稳定
D. 氢氧化钾溶液、石灰水都能使石蕊试液变蓝,是因为它们都含有OH-
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
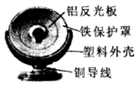 如图为电热扇的示意图.
如图为电热扇的示意图.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
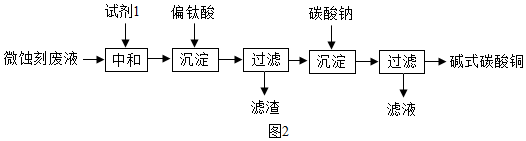
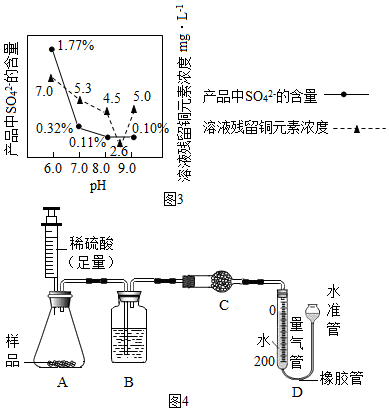
 ”为铜片).
”为铜片).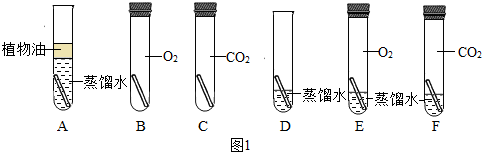
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com