
分析 纯碱中碳酸钠与稀盐酸反应放出二氧化碳,根据HCl的质量,根据反应的化学方程式,计算出二氧化碳、纯碱中碳酸钠的质量和反应后溶液中溶质氯化钠的质量,从而计算出反应后所得溶液中溶质的质量分数.
解答 解:(1)设参加反应的Na2CO3质量为x,生成的NaCl的质量为y,生成二氧化碳的质量为z.
由题意得HCl的质量为146g×20%=29.2g
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x 29.2g y 13.2g
$\frac{106}{x}$=$\frac{117}{y}$=$\frac{44}{z}$=$\frac{73}{29.2g}$
解之得 x=42.4g,y=46.8g,z=17.6g
纯碱样品中NaCl的质量=43.2g-42.4g=0.8g
反应后溶液中NaCl的质量为=46.8g+0.8g=36.5g
反应后溶液中NaCl的质量分数=$\frac{46.8g+0.8g}{43.2g+146g-17.6g}$×100%=27.7%
故答案为:(1)反应生成的气体的质量为17.6g
(2)该纯碱样品中Na2CO3的质量42.4gg;
(2)所得溶液中溶质的质量分数为27.7%
点评 反应后所得溶液中溶质氯化钠由原粉末中所含的氯化钠与反应后生成的氯化钠两部分所组成,解题时要注意到这点.


科目:初中化学 来源: 题型:选择题
| A. | +5 | B. | +3 | C. | +1 | D. | -3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
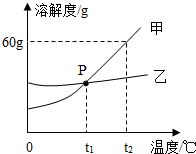 海水中蕴含着80多中元素,海洋是一座巨大的宝库.氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域.
海水中蕴含着80多中元素,海洋是一座巨大的宝库.氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 试剂 | 操作 |
| A | Fe | Fe2O3 | 盐酸 | 结晶 |
| B | NH4HCO3 | NaCl | - | 加热 |
| C | Cu(NO3)2溶液 | BaCl2 | AgNO3溶液 | 过滤 |
| D | O2 | 水蒸气 | 浓硫酸 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com