



 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:初中化学 来源: 题型:阅读理解

| ||
| △ |
| ||
| ||
| 实验组别 | 实验操作 | 实验现象 | 结论 |
| 实验1 | 取Zn、CuO粉末的均匀混合物于密闭容器中,高温加热. 向冷却后的固体中加入足量的稀盐酸. |
黑色粉末变成 红 红 色固体部分溶解,有气泡产生,水溶液呈无色. |
Zn和CuO能发生置换反应. |
| 实验2 | 取Mg、CuO粉末的均匀混合物于密闭容器中,高温加热. 向冷却后的固体中加入足量的稀盐酸. |
发生爆炸,黑色粉末变成红色. 固体部分溶解,有气泡产生,水溶液呈 无 无 色. |
镁与氧化铜能发生置换反应 镁与氧化铜能发生置换反应 |
| 实验3 | 取Cu、Fe2O3粉末的均匀混合物于密闭容器中,高温加热. | 粉末无变化 | Cu、Fe2O3不能反应. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| 加热 |
| 实验操作 | 实验现象 | 结论 | |
| 1 | 取Zn、CuO粉末的均匀混合物于密闭容器中,高温加热. 向冷却后的固体中加入足量的稀盐酸. |
黑色粉末变成 红 红 色固体部分溶解,有气泡产生,水溶液呈无色. |
Zn和CuO能发生置换反应. |
| 2 | 取Mg、CuO粉末的均匀混合物于密闭容器中,高温加热. 向冷却后的固体中加入足量的稀盐酸. |
发生爆炸,黑色粉末变成红色. 固体部分溶解,有气泡产生,水溶液呈 无 无 色. |
镁与氧化铜能发生置换反应 镁与氧化铜能发生置换反应 |
| 3 | 取Cu、Fe2O3粉末的均匀混合物于密闭容器中,高温加热. | 粉末无变化 | Cu、Fe2O3不能反应. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
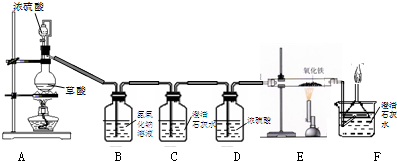
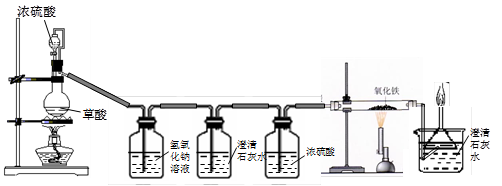
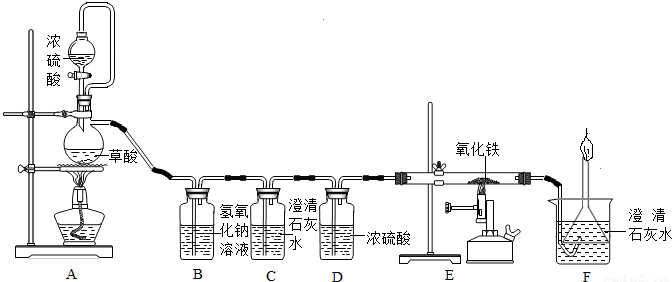
(12分)钢铁是使用最多的金属材料。在今年的化学活动周中,某校兴趣小组的同学在老师指导下做了二个有关铁的实验。
实验一:用干燥纯净的一氧化碳还原氧化铁
实验装置如下图:
其中A是实验室用草酸(H2C2O4)和浓硫酸加热制取一氧化碳的气体发生装置,反应的
(1)B装置中发生反应的化学方程式是 .
(2)C装置无明显现象,C装置的作用是 。
D装置中浓硫酸的作用是 。
(3)E装置中的实验现象是 。
(4)F装置的作用是 、 。
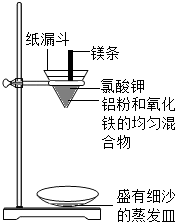
实验二:铝粉和氧化铁粉末反应(铝热反应)
实验装置如下图:
图中纸漏斗由两张滤纸折叠成漏斗状套在一起,使四周都有四层,点燃镁条后观察到的现象:镁条剧烈燃烧,发出耀眼的白光,放出大量的热,纸漏斗的下部被烧穿,有熔融物落入细沙中。
实验后老师作了如下提示:实验中镁条和氯酸钾的作用是提供反应所需的高温条件,铝粉和氧化铁粉末在高温条件下的反应叫铝热反应,属于置换反应,该反应常用于焊接钢轨。请写出该反应的化学方程式 。该反应中单质铝与一氧化碳有相似的 (填“氧化”或“还原”)性。
实验后同学们对金属与金属氧化物间的反应产生兴趣,激发了探究热情。
【提出问题】任何金属与金属氧化物在高温条件下都能反应吗?
同学们在请教老师后设计了如下实验方案并进行了探究。
【实验方案】
| 实验组别 | 实验操作 | 实验现象 | 结论 |
| 实验1 | 取Zn、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 | 黑色粉末变成 色
固体部分溶解,有气泡产生,水溶液呈无色。 | Zn和CuO能发生置换反应。 |
| 实验2 | 取Mg、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 | 发生爆炸,黑色粉末变成红色。 固体部分溶解,有气泡产生,水溶液呈 色。 |
|
| 实验3 | 取Cu、Fe2O3粉末的均匀混合物于密闭容器中,高温加热。 | 粉末无变化 | Cu、Fe2O3不能反应。 |
【实验总结】金属与金属氧化物在高温条件下有些能反应,有些不能反应。
【反思拓展】金属与金属氧化物在高温条件下反应的规律和金属与 的反应相似。
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 。请回答下列问题:
。请回答下列问题: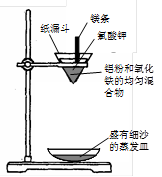
| 实验组别 | 实验操作 | 实验现象 | 结论 |
| 实验1 | 取Zn、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 | 黑色粉末变成 色 固体部分溶解,有气泡产生,水溶液呈无色。 | Zn和CuO能发生置换反应。 |
| 实验2 | 取Mg、CuO粉末的均匀混合物于密闭容器中,高温加热。 向冷却后的固体中加入足量的稀盐酸。 | 发生爆炸,黑色粉末变成红色。 固体部分溶解,有气泡产生,水溶液呈 色。 | |
| 实验3 | 取Cu、Fe2O3粉末的均匀混合物于密闭容器中,高温加热。 | 粉末无变化 | Cu、Fe2O3不能反应。 |
查看答案和解析>>
科目:初中化学 来源:《第5章 金属的冶炼与应用》2013年单元检测训练卷(一)(解析版) 题型:填空题
 H2O+CO2↑+CO↑.请回答下列问题:
H2O+CO2↑+CO↑.请回答下列问题:| 实验组别 | 实验操作 | 实验现象 | 结论 |
| 实验1 | 取Zn、CuO粉末的均匀混合物于密闭容器中,高温加热. 向冷却后的固体中加入足量的稀盐酸. | 黑色粉末变成 色 固体部分溶解,有气泡产生,水溶液呈无色. | Zn和CuO能发生置换反应. |
| 实验2 | 取Mg、CuO粉末的均匀混合物于密闭容器中,高温加热. 向冷却后的固体中加入足量的稀盐酸. | 发生爆炸,黑色粉末变成红色. 固体部分溶解,有气泡产生,水溶液呈 色. | |
| 实验3 | 取Cu、Fe2O3粉末的均匀混合物于密闭容器中,高温加热. | 粉末无变化 | Cu、Fe2O3不能反应. |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com