为了探究放置很久的铝片,其成分是否发生了变化,化学兴趣小组的同学查阅了许多资料,做了如下工作:
[探究准备]准确称取3.6g铝片样品和80g一定质量分数的稀盐酸;
[进行实验]使3.6g铝片样品与80g稀盐酸充分反应,铝片完全溶解并放出气体(假设该气体都是铝与稀盐酸反应生成的);
[收集数据]准确称量完全反应后溶液的总质量为83.3g;
[得出结论]请计算3.6g铝片样品中铝的质量,并回答铝片的成分是否发生了变化?
[反思交流]在金属活动性顺序中,铝的活动性比铁强,但很少见到生活中常用的铝制品生锈,为什么?
【答案】
分析:根据质量守恒定律,求出生成氢气的质量,再根据化学方程式,求出参加反应的铝的质量来判断铝片是否发生了变化;根据铝的性质来分析铝制品不易生锈的原因.
解答:解:【得出结论】生成氢气的质量=3.6g+80g-83.3g=0.3g
设生成0.3g氢气,需要参加反应的铝的质量为x
2Al+6HCl═2AlCl
3+3H
2↑
54 6
x 0.3g
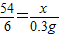
解之得:x=2.7g
3.6g>2.7g,铝片成分发生了变化.
答:铝片成分发生了变化.
【反思交流】铝在空气中被氧气氧化生成一层致密的氧化铝保护膜,能保护铝不被腐蚀;
点评:本题考查学生利用化学方程式进行计算的能力和铝的化学性质,要想解答好这类题目,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.认真地解答即可.

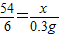 解之得:x=2.7g
解之得:x=2.7g

 综合自测系列答案
综合自测系列答案