
| 离子 | OH- | CO32- | Cl- |
| Na+ | 易溶 | 易溶 | 易溶 |
| Ca2+ | 微溶 | 不溶 | 易溶 |
| 73 |
| x |
| 44 |
| 4.4g |
| 7.3g |
| 100g |
| 111 |
| y |
| 100 |
| 20g |
| 22.2g |
| 100g |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:初中化学 来源: 题型:
| A、5.85g |
| B、11.7g |
| C、14.2g |
| D、23.4g |
查看答案和解析>>
科目:初中化学 来源: 题型:
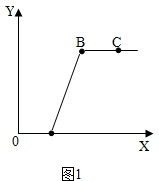
 现有盐酸和氯化钙的混合溶液,向其中逐滴加入过量的某物质X,溶液PH随滴入X的量的变化关系如图所示,则X是( )
现有盐酸和氯化钙的混合溶液,向其中逐滴加入过量的某物质X,溶液PH随滴入X的量的变化关系如图所示,则X是( )| A、水 | B、氢氧化钡溶液 |
| C、纯碱溶液 | D、烧碱溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:
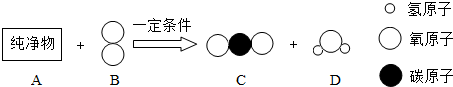
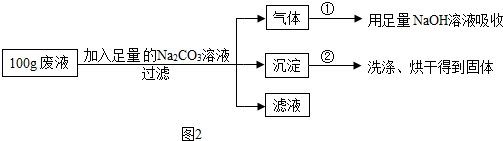
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
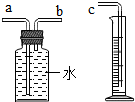 某化学兴趣小组对“锌与硫酸反应快慢的影响因素”进行了探究.
某化学兴趣小组对“锌与硫酸反应快慢的影响因素”进行了探究.| 实验编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌粉 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com