

| 装置C的质量/g | 装置D的质量/g | |
| 步骤③ | 292.4 | 198.2 |
| 步骤⑥ | 296.9 | 207.0 |
分析 (1)高温条件下,碳酸钙分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和稀盐酸反应生成氯化钙和水,电解熔融氯化镁生成镁和氯气,氢气在氯气中燃烧生成氯化氢,氯化氢溶于水形成盐酸;
(2)反应前后装置C中的质量差即为反应生成水的质量,装置D中的质量差即为反应生成二氧化碳的质量;
碱石灰能够吸收水蒸气和二氧化碳;
加热条件下,碳酸镁分解生成氧化镁和二氧化碳,氢氧化镁分解生成氧化镁和水;
根据提供的数据可以计算该碱式碳酸镁晶体[xMgCO3•yMg(OH)2•zH2O]中,x:y:z的值.
解答 解:(1)①A.步骤I通过两步反应即可实现,即碳酸钙分解生成氧化钙,氧化钙和水反应生成氢氧化钙,该选项说法不正确;
B.步骤II、III、IV的目的是从海水中提纯氯化镁,该选项说法正确;
C.步骤V中电能转化成化学能,该选项说法不正确;
D.该流程涉及的基本反应类型有分解反应,例如碳酸钙分解生成氧化钙和二氧化碳,氯化镁分解生成镁和氯气,化合反应,例如氧化钙和水反应生成氢氧化钙,复分解反应,例如氢氧化镁和稀盐酸反应生成氯化镁和水等3种,该选项说法不正确.
故填:B.
②该流程中采取的一种降低成本且减少污染的措施是:氯气和氢气反应生成氯化氢,氯化氢循环利用在步骤III中.
故填:氯气和氢气反应生成氯化氢,氯化氢循环利用在步骤III中.
(2)①装置A的作用为除去空气中的水蒸气和二氧化碳,装置D的作用为吸收反应生成的二氧化碳.
故填:除去空气中的水蒸气和二氧化碳;吸收反应生成的二氧化碳.
②反应后,装置B中的剩余固体是氧化镁,质量为:23.3g-(296.9g-292.4g)-(207.0g-198.2g)=10g.
故填:氧化镁;10.
③设碳酸镁质量为m,分解生成氧化镁质量为x,
MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,
84 40 44
m x 8.8g
$\frac{84}{m}$=$\frac{40}{x}$=$\frac{44}{8.8g}$,
m=16.8g,x=8g,
设氢氧化镁质量为n,分解生成水的质量为y,
氢氧化镁分解生成氧化镁的质量为:10g-8g=2g,
Mg(OH)2 $\frac{\underline{\;高温\;}}{\;}$MgO+H2O,
58 40 18
n 2g y
$\frac{58}{n}$=$\frac{40}{2g}$=$\frac{18}{y}$,
n=2.9g,y=0.9g,
zH2O的质量为:296.9g-292.4g-0.9g=3.6g,
根据题意有:$\frac{84x}{58y}$=$\frac{16.8g}{2.9g}$,$\frac{58y}{18z}$=$\frac{2.9g}{3.6g}$,
$\frac{x}{y}$=$\frac{1}{1}$,$\frac{y}{z}$=$\frac{1}{4}$,
则x:y:z=1:1:4.
故填:1;1;4.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 字词句段篇系列答案
字词句段篇系列答案科目:初中化学 来源: 题型:选择题
| A. | 木材制作桌椅 | B. | 棉花织布 | ||
| C. | 天然气作清洁燃料 | D. | 干冰用于人工降雨 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 结论 | |
| 步骤A | 将加热后的固体放入水中,搅拌、静置. | 底部有大量白色不溶物 | 剩余固体中含有碳酸钙 |
| 步骤B | 取上层清液,滴加无色酚酞试液. | 变红 | 剩余固体中含有 氧化钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 方案 | 实验操作 | 实验现象 | 结论 |
| 方案一 | 取少量滤液于试管中,在滤液中插入一根铜丝 | 铜丝表面无变化 | 猜想a成立 |
| 铜丝表面有银白色固体析出 | 猜想b成立 | ||
| 方案二 | 取少量滤液于试管中,滴加几 滴稀盐酸 | 滤液无明显变化 | 猜想a成立 |
| 生成白色沉淀 | 猜想b成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | 1H 1.008 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2He 4.003 |
| 2 | 3Li 6.941 | 4Be 9.012 | 5B 10.81 | 6C1 2.01 | 7N 14.01 | 8O 16.00 | 9F 19.00 | 10Ne 20.18 |
| 3 | 11Na 22.99 | 12Mg 24.31 | 13Al 26.98 | 14Si 28.09 | 15P 30.97 | 16S 32.06 | 17Cl 35.45 | 18Ar 39.95 |
 和
和 ,它们的单质易发生如图所示变化:
,它们的单质易发生如图所示变化:
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
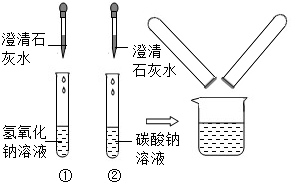 在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如图所示的实验.
在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如图所示的实验.| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,通入二氧化碳气体 | 试管中出现白色浑浊 | 你的猜想正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体于试管中,加水振荡直至完全溶解. | 不产生气泡 | 猜想 I不成立. |
| ②取少量①的溶液于试管中,滴加CaCl2溶液至过量. | 产生白色沉淀 | 证明有Na2CO3存在. |
| ③取少量②的溶液于试管中,加入几酚酞试液. | 酚酞试液变红色 | 证明有NaOH存在. |
| 综合以上实验现象,说明猜想 II是成立的. | ||
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 法国化学家拉瓦锡研究了空气的成分,并得出氧气约占空气总体积$\frac{1}{5}$的结论 | |
| B. | 空气中氧气含量的测定实验中,可以将红磷换成木炭 | |
| C. | 氮气是制造硝酸和氮肥的重要原料 | |
| D. | 稀有气体都没有颜色、没有气味,在通电时能发出不同颜色的光 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com