
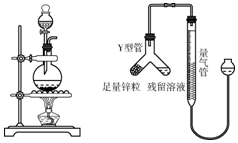
分析 (1)检查装置气密性之后,先向烧瓶中加入二氧化锰,再向烧瓶中加入浓盐酸,再加热;
(2)氯离子能和银离子反应生成白色沉淀氯化银;
气体的体积随着温度升高而增大,随着温度降低而减小;
锌和稀盐酸反应生成氯化锌和氢气,同时放热.
解答 解:(1)检查装置气密性之后的操作依次是向烧瓶中加入MnO2粉末,向烧瓶中加入浓盐酸,加热.
故填:ACB.
(2)①此方案不可行,这是因为氯化锰也能和硝酸银反应生成氯化银沉淀.
故填:不可行,因为氯化锰能和硝酸银反应生成氯化银沉淀.
②气体体积逐渐减小的原因是:锌和稀盐酸反应放热,完全反应后不再放热,温度逐渐降低,氢气体积减小.
故填:锌和稀盐酸反应放热,完全反应后不再放热,温度逐渐降低,氢气体积减小.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:选择题
| A. | 化学反应前后,催化剂的质量和性质都不变 | |
| B. | 催化剂可以提高也可降低某些化学反应的速率 | |
| C. | 一定量的双氧水中添加二氧化锰做催化剂不仅反应速率加快,产生氧气的量也会增加 | |
| D. | 任何化学反应都需要催化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 苯中的C、H元素的质量比为12:1 | |
| B. | 苯是由6个碳元素和6个氢元素组成 | |
| C. | 苯分子中碳的原子结构示意图为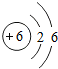 | |
| D. | 苯中碳、氢元素均位于元素周期表的第二周期 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
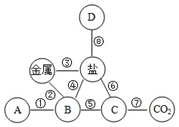 如图是小李同学构建的知识网络,其中A、B、C、D分别表示不同类别的化合物,“-”表示物质之间能够发生化学反应.请按要求回答下列问题:
如图是小李同学构建的知识网络,其中A、B、C、D分别表示不同类别的化合物,“-”表示物质之间能够发生化学反应.请按要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com