
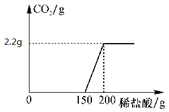
 老师拿出一瓶没有瓶盖的氢氧化钠固体取出50g样品实验如图,请同学们进行分析:(如图所示)
老师拿出一瓶没有瓶盖的氢氧化钠固体取出50g样品实验如图,请同学们进行分析:(如图所示)分析 (1)根据碳酸钠与盐酸反应的方程式,由生成的二氧化碳的质量可算出盐酸溶液的溶质的质量分数;再根据与氢氧化钠反应的化学方程式求出氢氧化钠的质量即可计算出50g样品中氢氧化钠的质量分数;
(2)根据氢氧化钠与二氧化碳的反应分析回答;
(3)根据氢氧化钠变质后生成的碳酸钠的性质分析回答.
解答 解:(1)由图象可知,与碳酸钠反应的稀盐酸的质量为:200g-150g=50g;
设50g的稀盐酸中溶质的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
x 2.2g
$\frac{73}{44}=\frac{x}{2.2g}$ 解得:x=3.65g
稀盐酸中溶质的质量分数为:$\frac{3.65g}{50g}×100%$=7.3%
由图象可知,与氢氧化钠反应的稀盐酸的质量为150g,溶质的质量为:150g×7.3%=10.95g
设50g样品中氢氧化钠的质量为y
HCl+NaOH=NaCl+H2O
36.5 40
10.95g y
$\frac{36.5}{40}=\frac{10.95g}{y}$ 解得:y=12g
50g样品中氢氧化钠的质量分数是:$\frac{12g}{50g}×100%$=24%
(2)氢氧化钠变质的原因是氢氧化钠与空气中的二氧化碳反应生成了碳酸钠和水,反应的化学方程式是:CO2+2NaOH═Na2CO3+H2O;
(3)氢氧化钠变质后有生成的碳酸钠,碳酸钠能与氢氧化钙反应生成了碳酸钙沉淀和氢氧化钠,所以提纯这瓶氢氧化钠,可以采取的方法是:加入适量的氢氧化钙溶液,过滤.
故答为:(1)50g样品中氢氧化钠的质量分数是24%;(2)CO2+2NaOH═Na2CO3+H2O;(3)加入适量的氢氧化钙溶液,过滤.
点评 本题主要考查了根据化学方程式的计算,了解氢氧化钠、碳酸钠的性质是解答本题的基础知识.


科目:初中化学 来源: 题型:选择题
| A. | 黄铜片和纯铜片:相互刻划比较硬度 | |
| B. | 棉线和羊毛线:灼烧后闻气味 | |
| C. | 硫酸铵固体和氯化铵固体:加熟石灰混合研磨后闻气味 | |
| D. | 氢氧化钠固体和硝酸铵固体:加水溶解后测温度 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
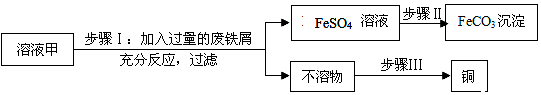
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 气体 | 实验药品 | 反应条件 | 气体物理性质 |
| H2S | 硫化亚铁固体与稀硫酸 | 不需加热 | 无色,密度比空气大,可溶于水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
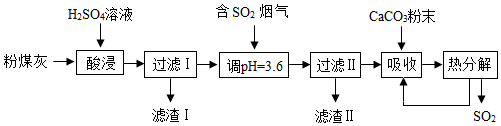
| PH值 | 0-5.5 | 5.5-8 | 8-14 |
| 存在形式 | Al3+ | Al(OH)3 | AlO2- |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度(℃) | 20 | 40 | 50 | 60 | 80 | |
| 溶解度(g/100g 水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
| NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
| KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 下列物质用于实验室制取气体,可以直接采用如图所示装置的是C
下列物质用于实验室制取气体,可以直接采用如图所示装置的是C查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂所用的试剂和方法 | |
| A | 氮气 | 氧气 | 木条,点燃 |
| B | 稀硫酸 | 稀盐酸 | 加入适量的硝酸银溶液,过滤 |
| C | 氢氧化钠溶液 | 氢氧化钡溶液 | 加入适量的碳酸钠溶液、过滤 |
| D | 氯酸钾 | 氯化钾 | 加入少量二氧化锰,加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com