

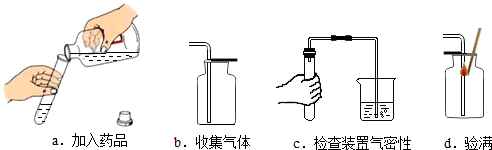
分析 (1)根据实验室制取二氧化碳的反应原理,进行分析解答.
(2)根据制取二氧化碳的步骤(连→查→加→倒→收→验)进行分析解答即可.
(3)制取二氧化碳的发生装置属于固液常温型,据此进行分析解答.
解答 解:(1)小华要制取二氧化碳,应该从以上药品选择石灰石和稀盐酸,石灰石与稀盐酸反应,反应速度适中,操作安全方便,便于收集;石灰石与稀硫酸反应,生成微溶于水的硫酸钙,硫酸钙覆盖在石灰石表面,阻止反应进一步进行;浓盐酸具有挥发性,会使制取的气体不纯净.
不能选择木炭和氧气,因为有气体参加反应,气体产物不便收集.
(2)制取二氧化碳的操作步骤是:连(连接仪器、组装实验装置)→查(检查装置的气密性)→加(向试管中装入石灰石)→倒(注入稀盐酸)→收集(用向上排空气法收集)→验满(将燃着的木条放在集气瓶口).则正确的操作顺序为:cabd;操作有误的是d,因为验满时,应将燃着的木条放在瓶口,不能伸入瓶中.
(3)制取二氧化碳的发生装置属于固液常温型,还可以制取氧气,原因是制取氧气的反应物状态和反应条件与制取CO2相同.
故答案为:(1)稀盐酸;能连续反应,便于收集,制得的气体较纯净;有气体参加反应,气体产物不便收集;(2)cabd;d;(3)氧气;制取氧气的反应物状态和反应条件与制取CO2相同.
点评 本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取气体的反应原理、发生装置和收集装置的选择依据是正确解答本题的关键.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 因为H2O和H2O2的组成元素相同,所以它们的化学性质相同 | |
| B. | 因为燃烧需要同时满足三个条件,所以灭火也要同时控制这三个条件 | |
| C. | 酸雨的pH小于7,所以pH小于7的雨水一定是酸雨 | |
| D. | 因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有C和H |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 甲、乙两位同学做如下两个实验,请回答:
甲、乙两位同学做如下两个实验,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气、纯碱、空气 | B. | 氢气、硫酸、碱式碳酸铜 | ||
| C. | 水、烧碱、生铁 | D. | 金刚石、熟石灰、石油 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酸溶液中一定含有氢离子 | |
| B. | 气体受热膨胀是因为温度升高气体分子变大 | |
| C. | 生成盐和水的反应一定是中和反应 | |
| D. | 铝合金、塑料、玻璃钢都是复合材料 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
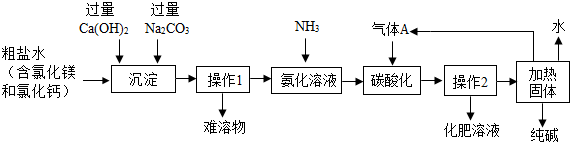
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com