
| A. | X的化学式是N2 | B. | 黑火药是混合物 | ||
| C. | 该反应遵循质量守恒定律 | D. | 该反应属于复分解反应 |
分析 A、由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
B、根据题意,黑火药的主要成分是硝酸钾、碳和硫,据此进行分析判断.
C、根据化学反应遵循质量守恒定律进判断.
D、根据复分解反应的特点进判断.
解答 解:A、根据反应的化学方程式S+2KNO3+3C=K2S+N2+3X,反应物中S、K、N、O、C原子个数分别为1、2、2、6、3,反应后的生成物中S、K、N、O、C原子个数分别为1、2、0、6、3,根据反应前后原子种类、数目不变,则每个X分子由2个氮原子构成,则物质X的化学式为N2,故选项说法正确.
B、黑火药的主要成分是硝酸钾、碳和硫,属于混合物,故选项说法正确.
C、该反应遵循质量守恒定律,故选项说法正确.
D、复分解反应的特点为两种化合物相互交换成分生成另外的两种化合物,而“2KNO3+3C+S$\frac{\underline{\;点燃\;}}{\;}$K2S+3CO2↑+N2↑”,则不符合复分解反应的特点,故选项说法错误.
故选:D.
点评 本题难度不大,掌握化学反应前后原子守恒、复分解反应的特点是正确解答本题的关键.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:推断题
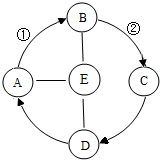 A、B、C、D、E是初中化学常见的五种物质,A、B、C、E物质类别分别属于氧化物、酸、碱、盐中的一种.化学兴趣小组同学设计了如图所示的各物质间关系,箭头表示一种物质可以转化成另一种物质,短线表示相连两种物质会发生化学反应(部分反应物、生成物以及反应条件省略).若A是食品干燥剂的一种,C和D的物质类别相同且C为D与E的反应产物之一,E的浓溶液有挥发性,①和②的转化过程为放热反应.则
A、B、C、D、E是初中化学常见的五种物质,A、B、C、E物质类别分别属于氧化物、酸、碱、盐中的一种.化学兴趣小组同学设计了如图所示的各物质间关系,箭头表示一种物质可以转化成另一种物质,短线表示相连两种物质会发生化学反应(部分反应物、生成物以及反应条件省略).若A是食品干燥剂的一种,C和D的物质类别相同且C为D与E的反应产物之一,E的浓溶液有挥发性,①和②的转化过程为放热反应.则 查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 待提纯物质 | 选用试剂 |
| A | CO2(H2O) | 生石灰 |
| B | Fe(Cu) | 稀硫酸 |
| C | CuSO4(硫酸溶液) | 铜粉 |
| D | NaCl(Na2CO3) | 盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
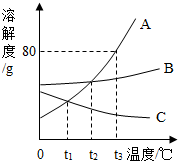 如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com