
向一定质量的稀盐酸中加入100gAgNO3溶液,恰好完全反应。过滤后得28.7g白色沉淀和121.3g滤液。求稀盐酸中溶质的质量分数。
科目:初中化学 来源: 题型:
小丽利用底部有一个小孔的大试管,如图甲所示配制成一个制取CO2气体的装置.
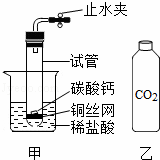
(1)实验前,关闭止水夹,先将试管底部稍浸没在水中,再用双手紧握试管,观察到 ,则说明装置气密性良好;
(2)小丽将CO2通入盛有NaOH溶液的试管中,观察不到明显现象,那么CO2与NaOH是否发生反应?为此又做了实验:在集满CO2的软塑料瓶(如图乙)中加入适量的NaOH溶液,盖紧瓶塞振荡,发生瓶变瘪,于是认为CO2与NaOH发生了反应,小衢提出质疑,认为导致软塑料瓶变瘪的原因还有可能是 ;
(3)小科从变瘪的软塑料瓶中取出少量试液置于试管中,滴入 溶液(填一种盐),观察到有白色沉淀产生,就证明了CO2与NaOH的反应确实已经发生.
查看答案和解析>>
科目:初中化学 来源: 题型:
向100g稀盐酸中加入10gNaHCO3和CaCO3的固体混合物,充分反应后,反应物均恰好完全反应,生成ag气体。则下列结论合理的是( )
A.a≥4.4 B.a≥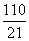
C.原固体混合中CaCO3的质量为5.6g D.原稀盐酸的溶质质量分数小于7.3%
查看答案和解析>>
科目:初中化学 来源: 题型:
三位同学分别用相同质量分数的稀盐酸,测定某石灰石样品中碳酸钙的质量分数(石灰石中的杂质既不与酸反应,也不溶于水)。
(1)小敏的方法可用如下流程表示,测得的碳酸钙质量分数为_____________;他在过滤操作中,需要用到的玻璃仪器有_______________(选填序号)。
A.酒精灯、漏斗、玻璃棒 B.漏斗、玻璃棒、烧杯 C.酒精灯、试管、玻璃棒
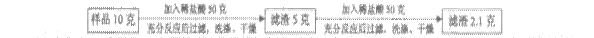
(2)小华取10克样品,用如图甲实验装置进行实验,反应结束后,测得B装置质量增加了4.6克,算得碳酸钙的质量分数,发现与事实严重不符,造成这种情况的可能原因是________________________________________________________。
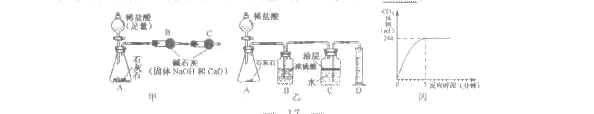
(3)小军用如图乙的实验装置进行实验,将20克稀盐酸加入到1.25克样品中,生成的CO2体积与反应时间的关系如图丙。已知本实验条件下CO2的密度为1.8克/升。求该石灰石样品中CaCO3的质量分数。
(4)求实验所用的稀盐酸的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
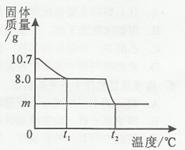
胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4·xH2O),华雪同学为研究CuSO4·xH2O加热后所得物质的组成,做了以下实验:取10.7g CuSO4·xH2O晶体加热使其分解,绘制出固休的质量随温度的变化关系图。如图所示,到t1℃时该固体完全失去结晶水,化学方程式为:
CuSO4·xH2O CuSO4+ xH2O↑
CuSO4+ xH2O↑
(1)计算该硫酸铜晶体(CuSO4·xH2O)中x的值。
(CuSO4·xH2O的相对分子质量为:160+18x)
(2) CuSO4中铜元素的质量分数是多少?
(3)升温到t2℃,残留固体是黑色物质,则m= g。 (写出求m的过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液(含NaOH35%~48%)。某学习小组为了验证附近氯碱化工厂产生的NaOH溶液是否达到高浓度标准,进行了如下操作,请你参与计算:
(1)到工厂采集了电解槽中的NaOH溶液100g。NaOH中氧元素的质量分数是 。
(2)在实验室用如右图所示浓硫酸配制200g24.5%的稀硫酸,计算所取浓硫酸的体积 (计算结果取整数)。

(3)进行中和测定,向采集到的溶液中逐滴加入所配制的稀硫酸,并不断测定溶液的pH值,当pH=7时,消耗稀硫酸160g。通过计算判断此时电解槽中NaOH溶液是否达到高浓度标准。
查看答案和解析>>
科目:初中化学 来源: 题型:
将3.9克过氧化钠(Na2 O2)加入质量为63.9克的水中,完全反应后,在该溶液中加入50克稀盐酸,两者恰好完全反应:(提示:过氧化钠与水反应的化学方程式为:2Na2O2+2H2O===4NaOH+O2↑,不考虑氧气溶于水)
(1)反应生成氧气的质量为______克。
(2)计算最后所得溶液中溶质的质量分数。(请写出解题过程)
(3)若要使最后所得溶液中溶质的质量分数增加一倍,应将最后所得溶液蒸发掉
________________克水。
查看答案和解析>>
科目:初中化学 来源: 题型:
实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g10%的NaOH溶液,然后往烧杯中滴加该盐酸。反应过程中溶液的pH与滴人盐酸的质量关系如图所示。请回答下列问肠:
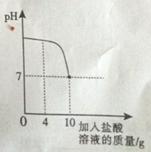
(1)配制8g 10%的NaOH溶液,需要水的质量为
(2)计算该盐酸的溶质质量分数;(写出计算过程)
(3)当滴人4g盐酸时,烧杯内溶液中钠元素的质量为 g
查看答案和解析>>
科目:初中化学 来源: 题型:
重铬酸钾(K2Cr2O7,Mr=294。铬元素为+6价,Mr表示相对分子质量)是一种重要的化工原料,在皮革工业、有机反应中都有广泛应用。但+6价铬有很强的毒性易污染环境,使用后,须用绿矾(FeSO4·7H2O,Mr=278)将其变成低毒性+3价铬才能做后续处理.
反应原理:6FeSO4·7H2O+ K2Cr2O7+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+49H2O
现有1.0吨重铬酸钾需要处理,计算需要绿矾多少吨?(写出计算过程,结果精确小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com