

分析 根据质量守恒定律,求生成气体的质量;
根据碳酸钠和氯化钙反应的化学方程式,已知氯化钙的质量可以求出生成的碳酸钙的质量,从而完成该题的解答.
解答 解:(1)依据题意及质量守恒定律可知,溶液质量的减少量即为生成气体的质量.
则生成气体的质量为95.4g+20g+100g-211g=4.4g
(2)设样品中碳酸钠的质量为x,恰好完全反应生成氯化钠的质量为y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
则$\frac{106}{x}$=$\frac{44}{4.4g}$,$\frac{117}{y}=\frac{44}{4.4g}$
解得:x=10.6g,y=11.7g
该样品中氯化钠的质量分数=$\frac{20g-10.6g}{20g}$×100%=47%.
(3)反应后溶液中溶质的质量为:(20g-10.6g)+11.7g=21.1g
溶液中水的质量为211g-21.1g
设将该不饱和溶液配置成15%的氯化钠溶液所得溶液的质量为(211g-21.1g)÷(1-85%)≈223.4g
则加入氯化钠的质量为223.4g-211g=12.4g
将所得不饱和溶液配置成15%的氯化钠溶液需要向溶液中加入氯化钠12.4g.
故答案为:
(1)4.4;(2)47%.(3)12.4g
点评 本题中考查的知识点较多,主要是依据化学方程式进行计算,在解答时要注意运用质量守恒定律来得出计算所必须的已知量,然后依据化学方程式进行计算.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
 元素周期表中关于碘元素的信息如图.下列关于碘元素的说法错误的是( )
元素周期表中关于碘元素的信息如图.下列关于碘元素的说法错误的是( )| A. | 是人体必需的微量元素 | B. | 原子核内质子数为53 | ||
| C. | 原子核内中子数为53 | D. | 相对原子质量为126.9 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 净化后的空气、雪碧饮料 | B. | 冰水混合物、澄清石灰水 | ||
| C. | 汽水、石灰石 | D. | 液态氧、生石灰 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 镉是金属元素 | B. | 镉原子的相对原子质量为112 | ||
| C. | 镉原子的核电荷数为48 | D. | 镉原子的核外电子数为64 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 柠檬2.2~2.4 | B. | 鸡蛋清7.6~8.0 | C. | 西红柿4.0~4.4 | D. | 牛奶6.3~6.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 合金:生铁、锰钢、青铜 | B. | 碱:纯碱、烧碱、消石灰 | ||
| C. | 盐:氯化银、氯化钠、氯化氢 | D. | 合成材料:塑料、合成纤维、铝合金 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

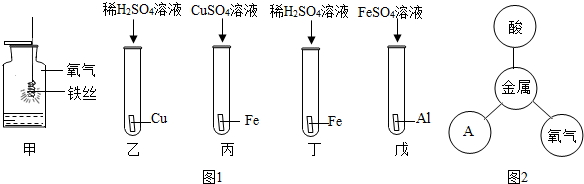

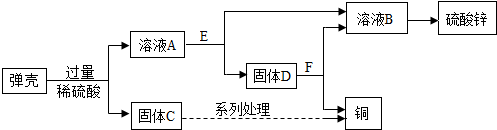
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com