
| A. | Cu | B. | Mg | C. | Al | D. | Fe |
分析 采用极值法先计算纯锌6.5g能生成氢气的质量,然后再确定杂质的类别.
解答 解:6.5g锌、镁、铝、铁与足量的盐酸反应能生成氢气的质量分别为$\frac{2}{65}$×6.5g>0.18g、$\frac{2}{24}$×6.5g>0.18g、$\frac{3}{27}$×6.5g>0.18g、$\frac{2}{56}$×5.6g>0.18g,而铜不反应,不能产生氢气,根据平均值法,若是锌与铁或镁或铝的混合物,则生成的氢气质量应该大于0.2g,不可能为0.18g,故混有的杂质是铜;
故选A.
点评 本题考查了混合金属与酸反应生成氢气的质量关系,完成此类题目,可以首先采用极值法,然后采用平均值法进行.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:初中化学 来源: 题型:选择题
| A. | FeO(Fe):滴加足量稀盐酸,过滤 | |
| B. | CO(CO2):将气体在空气中点燃 | |
| C. | Cu(NO3)2溶液(AgNO3):加入过量的铜粉 | |
| D. | KCl溶液(CaCl2):加入适量Na2CO3溶液,过滤 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
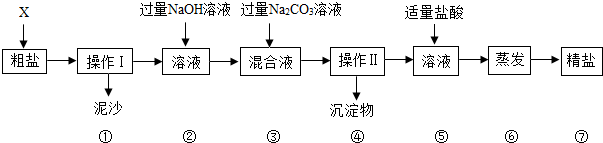
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
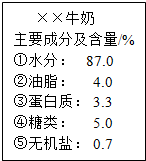 如图为某品牌牛奶的部分标签,请据此回答下列问题:
如图为某品牌牛奶的部分标签,请据此回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com