
分析 (1)碳酸钙与盐酸反应只放出一种气体二氧化碳使反应前后质量出现差异,因此,使用质量守恒定律,可由反应前后质量差计算出生成二氧化碳的质量;
(2)由反应放出二氧化碳的质量,根据反应的化学方程式计算参加反应的碳酸钙的质量和盐酸中氯化氢的质量,碳酸钙质量与样品的质量比可计算石灰石样品中碳酸钙的质量分数.
(3)利用溶液中溶质质量分数进行解答.
解答 解:
(1)根据质量守恒定律,恰好完全反应后生成二氧化碳的质量=50.0g+12.0g-57.6g=4.4g;
(2)设样品中碳酸钙的质量为x,生成氯化钙的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
$\frac{100}{x}=\frac{111}{y}=\frac{44}{4.4g}$
解得:x=10g y=11.1g
(2)样品中碳酸钙的质量分数=$\frac{10g}{12g}×$100%=83.3%
(3)所得溶液的溶质质量分数=$\frac{11.1g}{57.6g-2g}×$100%≈19.7%
答案:
(1)4.4g
(2)石灰石样品中碳酸钙的质量分数是83.3%
(3)所得溶液的溶质质量分数为19.7%
点评 根据反应的化学方程式可以表示反应中各物质的质量比,由反应中任一物质的质量可计算出反应中其它物质的质量.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:填空题
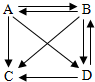 某同学画出的四种物质之间的转化关系图,A、B、C、D代表最常见的含有钠离子的四种物质的溶液,“→”表物质间的转化关系,所有的转化关系都可以通过复分解反应实现.钠离子的符号是Na+,C中溶质的化学式NaNO3 .写出A→B的化学方程式2NaOH+CO2═Na2CO3+H2O;写出D→C的化学方程式NaCl+AgNO3═AgCl↓+NaNO3 .
某同学画出的四种物质之间的转化关系图,A、B、C、D代表最常见的含有钠离子的四种物质的溶液,“→”表物质间的转化关系,所有的转化关系都可以通过复分解反应实现.钠离子的符号是Na+,C中溶质的化学式NaNO3 .写出A→B的化学方程式2NaOH+CO2═Na2CO3+H2O;写出D→C的化学方程式NaCl+AgNO3═AgCl↓+NaNO3 .查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶解度为34g | |
| B. | 是一种易溶物 | |
| C. | 溶质质量分数的最大值为30% | |
| D. | 若要使20℃时饱和溶液的质量分数增大一倍,可采用蒸发溶剂的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com