
 将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL[已知该条件下CO2的密度为(44÷22.4)g/l,忽略CO2溶于水情况.已知CaCO3+H2O+CO2=Ca(HCO3)2]CO2+Ca(OH)2=CaCO3↓+H2O
将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL[已知该条件下CO2的密度为(44÷22.4)g/l,忽略CO2溶于水情况.已知CaCO3+H2O+CO2=Ca(HCO3)2]CO2+Ca(OH)2=CaCO3↓+H2O分析 KOH和Ca(OH)2混合物溶于水中形成稀溶液,通入足量的CO2气体所发生的离子反应有:
①2OH-+CO2=CO32-,②CO32-+Ca2+=CaCO3↓③CaCO3+CO2+H2O=Ca(HCO3)2,
根据以上反应,可把反应分为四个阶段:
(1)二氧化碳会先和氢氧化钙反应生成碳酸钙沉淀,方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
(2)二氧化碳会继续和氢氧化钾反应,方程式为2K0H+CO2=K2CO3+H2O,
(3)二氧化碳会继续和碳酸钾反应,方程式为K2CO3+CO2+H2O=2KHCO3,
(4)二氧化碳会继续和碳酸钙反应生成碳酸氢钙,方程式为CaCO3+CO2+H2O=Ca(HCO3)2,
据消耗CO2的体积为224mL结合化学方程式计算.
解答 解:(1)二氧化碳会先和氢氧化钙反应生成碳酸钙沉淀,方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)根据反应方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
设氢氧化钙的物质的量为x,那么x应该等于二氧化碳的量,即$\frac{0.224L}{22.4L/mol}$=0.01mol,
所以氢氧化钙的质量为0.01mol×74g/mol=0.74g,
故答案为:0.74;
(3)1.86gKOH和Ca(OH)2混合物中,n(KOH)=$\frac{1.86g-0.74g}{56g/mol}$=0.02mol,
沉淀恰好溶解时,所反应的反应以此有:
①CO2+Ca(OH)2=CaCO3↓+H2O
0.01mol 0.01mol
②2K0H+CO2=K2CO3+H2O
0.02mol 0.01mol
③K2CO3+CO2+H2O=2KHCO3,
0.01mol 0.01mol
④CaCO3+CO2+H2O=Ca(HCO3)2
0.01mol 0.01mol
沉淀恰好溶解时,消耗CO2的物质的量为0.01mol+0.01mol+0.01mol+0.01mol=0.04mol,
体积为:0.04mol×22.4L/mol=0.896L,即896ml,
故答案为:896;
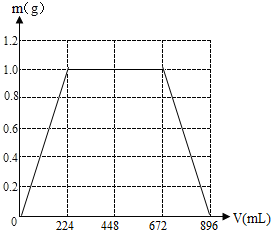
3、①当V≤224ml时,反应为CO2+Ca(OH)2=CaCO3↓+H2O,$\frac{Vml}{22400ml/mol}=\frac{mg}{100g/mol}$,m=$\frac{V}{224}$g;
②当224<V≤672ml时,反应为①CO2+Ca(OH)2=CaCO3↓+H2O,②2K0H+CO2=K2CO3+H2O③K2CO3+CO2+H2O=2KHCO3,
m=0.01mol×100g/mol=1g;
③当672<V<896L时,反应为CaCO3+CO2+H2O=Ca(HCO3)2,$\frac{(V-672)ml}{22400ml/mol}=\frac{(1-m)g}{100g/mol}$,m=(1-$\frac{V-672}{224}$)g;
④当V≥896ml时,m=0g,方程式为K2CO3+CO2+H2O=2KHCO3
故答案为:
| V的取值范围 | m=f(V) |
| 0≤V<224 | m=V/224 |
| 224≤V≤672 | m=1 |
| 672≤V≤896 | m=1-(V-672)/224 |
 .
.点评 本题考查混合物的计算,题目难度较大,注各阶段的反应物的物质的量以及发生的化学反应,用讨论法计算.


科目:初中化学 来源: 题型:选择题
| A. | 用二氧化碳作气体肥料 | B. | 用碳酸氢钠治疗胃酸过多 | ||
| C. | 用大理石作建筑材料 | D. | 用氮气填充到食品袋中以防腐 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 粗盐的晶粒大一些有利于提纯 | |
| B. | 设计实验的根据是MgCl2比NaCl易溶于水 | |
| C. | 设计实验的根据是NaCl的溶解与结晶平衡 | |
| D. | 在整个过程中NaCl饱和溶液浓度会变大(温度不变) |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 洗涤剂洗油污,是利用它能乳化油污的性质 | |
| B. | 氮气用来保护粮食,是利用氮气常温下化学性质稳定 | |
| C. | 稀有气体充入霓虹灯,是利用稀有气体通电能发出不同颜色的光 | |
| D. | 氧气用于火箭发射,是利用氧气的可燃性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com