
| A. | 4.8g | B. | 9.6g | C. | 13.6g | D. | 16.8g |
分析 根据质量守恒定律可知反应后所得溶液的质量是:20.4g+325g-5.4g=340g,镁和硫酸反应生成硫酸镁和氢气,碳酸镁和硫酸反应生成硫酸镁、二氧化碳、水,由此可知所得溶液的溶质为MgSO4,根据元素守恒可知硫酸镁中镁元素的质量即为原固体混合物中镁元素的质量.
解答 解:镁粉和碳酸镁与硫酸反应的化学方程式为Mg+H2SO4=MgSO4+H2↑;MgCO3+H2SO4=MgSO4+H2O+CO2↑,根据质量守恒定律可知反应后所得溶液的质量是:20.4g+325g-5.4g=340g,则含有硫酸镁的质量为340g×20%=68g;
硫酸镁中镁元素的质量为68g×$\frac{24}{24+96}$×100%=13.6g;
根据元素守恒知镁粉和碳酸镁组成的混合物中镁元素的质量为硫酸镁中镁元素的质量;
故选C.
点评 解答本题主要是利用质量守恒定律、化学反应恰好元素质量守恒进行解答.在解多步反应计算或混合物计算中可以省略中间步骤,加快解题速度.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
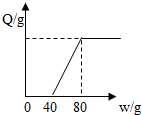 向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )
向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )| A. | 14.2% | B. | 7.1% | C. | 3.55% | D. | 10% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某化学兴趣小组利用废旧干电池回收原料中的二氧化锰和氯化铵查阅资料:废旧干电池的填料的主要成分为二氧化锰氯化铵氯化锌等,其中氯化氨氯化锌可溶于水.兴趣小组同学们我,设计回收物质的流程如图所示:
某化学兴趣小组利用废旧干电池回收原料中的二氧化锰和氯化铵查阅资料:废旧干电池的填料的主要成分为二氧化锰氯化铵氯化锌等,其中氯化氨氯化锌可溶于水.兴趣小组同学们我,设计回收物质的流程如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 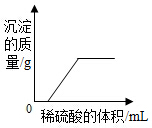 向氯化钡和氢氧化钠的混合溶液中滴加稀硫酸 | |
| B. |  用相同质量的氯酸钾固体加热分解来制取氧气 | |
| C. | 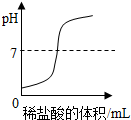 向一定体积的氢氧化钠溶液中逐滴加入稀盐酸 | |
| D. |  向一定质量一定质量分数的稀盐酸中加入铁粉 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气质量约占空气总质量的$\frac{1}{5}$ | |
| B. | 氧气可以支持燃烧,说明氧气具有可燃性 | |
| C. | 工业上用分离液态空气法制取氧气是分解反应 | |
| D. | 氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com